Cygnus Technologies 近日宣布将MockV Solutions公司旗下产品线整合至CygnusTechnologies品牌中。Mock VSolutions是一家研发生物工艺中病毒清除情况检测产品的公司。MockV Solutions的加入使Cygnus Technologies产品线进一步扩大,并进一步确立其在全球生物工艺污染物检测的领先地位。
在治疗药物产品的生产中,例如抗体药物、疫苗产品、血液制品等,病毒污染是一项固有的风险,它不仅可以导致工厂停工,更严重的情况下,可以影响药品安全及病人身体健康。中国NMPA、美国FDA、欧洲CPMP/BWP以及ICH等全球的药品监管机构都需要制药企业对产品中病毒清除/灭活的情况进行验证。并且,各机构对产品研发的不同阶段所需要验证的项目和标准也有所不同。例如,IND阶段,需要对以逆转录病毒、细小病毒和疱疹病毒的清除能力做出验证。病毒清除情况的验证通常需要通过活病毒实验来完成。但是由于开展活病毒实验需要对实验场所、设备、人员等有着一系列特殊的要求,这给这项验证工作和生物技术企业带来了很多挑战。而且如果验证失败,将在金钱和时间上造成过大的损失。
MockV Solutions开发了一种基于Mock Virus Particles(MVPs)的技术用于工艺中病毒清除情况的确认。MVPs的形态、理化性质以及功能都类似于病毒,但不具有传染性。因此可将MVPs作为活病毒的替代品加入并应用到纯化过程中,再对纯化后得到的溶液进行Immuno-qPCR检测确定病毒清除情况。
现阶段MockV Solutions已经推出MVM-MVP试剂盒(货号M-219),即模拟小鼠细小病毒(MVM)的MVP试剂用于病毒清除研究(MVM是一种模式细小病毒并常用作生物制药工艺验证的国际监管标准)。同时,MockV Solutions还在研发用于模拟逆转录病毒的清除验证相关产品(RVLP),预计于2021年上市。
现阶段由于这项技术刚刚应用不久,MVM-MVP等试剂盒还不能完全替代产品最终申报时采用活病毒所做的验证。但这些试剂盒可以在真正开展活病毒验证前,以一种经济实用的方式积累数据提供理论基础。当有了多年研发工艺中积累的这些有效和稳定的数据时再开展活病毒验证会避免验证的失败,从而减少潜在的时间和金钱损失。同时,MockV团队已经与FDA共同开展了一些研究(如Characterization of Non-Infectious Virus Like Particle Surrogates for Viral Clearance Application. Johnson et al. 2017)来比较MVM-MVP与活病毒验证的差异,并正在推动MVP技术至少可以替代IND阶段的活病毒验证数据的工作。所以,从工艺初期就采用MVM-MVP试剂盒对病毒清除情况进行验证,不仅可以在长期的研发阶段中积累重要的数据,更有可能在未来产品申报时减少验证工作量和时间。
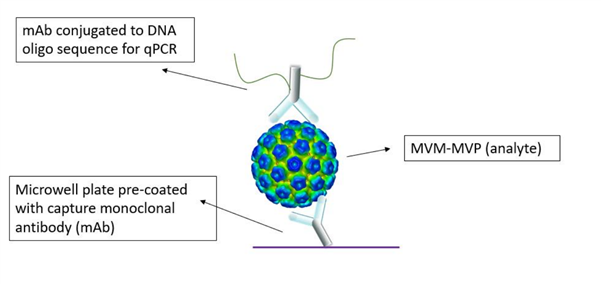
MVM-MPV试剂盒Immuno-qPCR检测原理
作为Cygnus中国一级代理,上海金畔生物科技有限公司多年来向中国客户提供了高品质的HCP、DNA、ProteinA等污染残留检测产品,以及AAE覆盖率验证,专属抗体和试剂盒开发等服务项目。上海金畔生物科技有限公司对Mock VSolutions能够加入到Cygnus Technologies品牌表示衷心的祝福,希望今后能为中国客户提供更多更好的产品和服务。为了能让更多的中国客户了解MockV的技术和产品,上海金畔生物科技有限公司邀请Cygnus高级研发总监David Cetlin (原MockV Solutions CEO)通过网络视频的形式举办线上Webinar介绍关于MVM-MVP试剂盒及相关技术原理,并且观众可以现场与David互动答疑解决对该产品和技术存在的疑问。本次线上研讨会暂定于2020年4月底(具体时间会另行通知),如有感兴趣的客户请通过上海金畔生物科技有限公司公众号报名参加。
报名方式:扫描文末下方二维码关注上海金畔生物科技有限公司微信公众号,在公众号底部菜单“客户服务”→“资料索取”中填写表单并在最后一栏中备注“MVM”,提交即可完成报名,我们会提前将参会详情通知已报名的客户。

