上海金畔生物科技有限公司代理AAT Bioquest荧光染料全线产品,欢迎访问AAT Bioquest荧光染料官网了解更多信息。
钙离子荧光探针Cal Red R525/650 potassium salt价格 2823
产品规格
产品货号
| Ex (nm) | – | Em (nm) | – |
| 分子量 | ~1000 | 溶剂 | Water |
| 存储条件 | 在零下15度以下保存, 避免光照 |
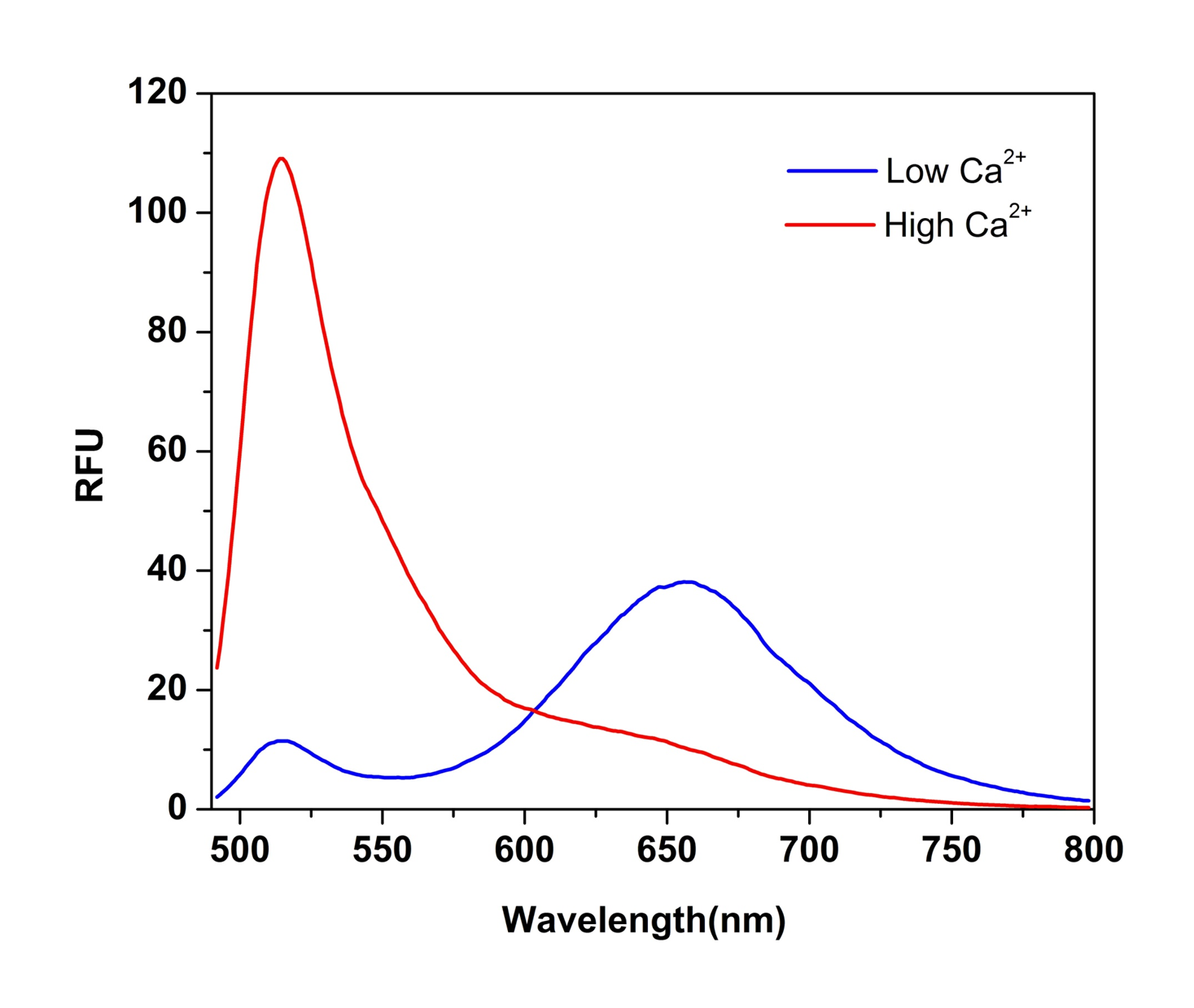
细胞内钙通量测定法是监测GPCR和钙通道活性的一种广泛使用的方法。为了定量细胞内钙浓度,优选比例荧光荧光指示剂,因为该比率与钙浓度直接相关并且与细胞数和染料负载浓度无关。但是,流行的比例钙指示剂(例如Fura-2和Indo-1)具有一定的局限性,例如灵敏度较低,紫外线激发,并且与HTS筛选滤光片组不兼容。Cal Red R525 / 650已开发为新型的488 nm可激发比例荧光钙指示剂。Cal Red R525 / 650在488 nm处受到很好的激发,在525 nm和650 nm处有两次发射。结合钙后 当在488 nm激发时,Cal Red R525 / 650的发射信号在525 nm处增加,在650 nm处降低。Cal Red R525 / 650的激发和发射波长与普通滤光片组兼容,对细胞的损害小,使其成为评估和筛选GPCR激动剂和拮抗剂以及钙通道靶标的强大工具。
钙离子篇:时间轴式讲解应用于钙离子检测的探针
使用Cal-520 AM,Cal-570 AM或Cal-630 AM酯类
1.使用Cal-520 ,Cal-590 或Cal-630 AM酯:
AM酯是非极性酯,其易于穿过活细胞膜,并且通过活细胞内的细胞酯酶快速水解。AM酯广泛用于非侵入性地将各种极性荧光探针装载到活细胞中。但是,使用AM酯时必须小心,因为它们易于水解,特别是在溶液中。它们应在使用前重新配制成高质量的无水二甲基亚砜(DMSO)。DMSO储备溶液可以在-20℃下干燥储存并避光。在这些条件下,AM酯应稳定数月。以下是我们推荐的将Cal-520 AM,Cal-590 AM或Cal-630 AM酯加入活细胞的方案。该方案仅提供指南,实际应根据您的具体需求进行修改。
a)在高质量无水DMSO中制备2至5 mM Cal-520 AM,Cal-590 AM或Cal-630 AM酯的储备溶液。
b)在实验当天,将Cal-520 AM,Cal-590 AM或Cal-630 AM溶解在DMSO中或将等份的指示剂储备溶液解冻至室温。在Hanks和Hepes缓冲液(HHBS)或您选择的缓冲液(0.04%Pluronic®F-127)中制备10至20μM的染料工作溶液。细胞加载所需指示剂的确切浓度必须凭经验确定。
注意:非离子型洗涤剂Pluronic®F-127有时用于增加Cal-520 AM,Cal-590 AM或Cal-630 AM酯的水溶性。
c)如果您的细胞(如CHO细胞)含有有机阴离子转运蛋白,可将丙磺舒(1-2 mM)加入染料工作溶液中(终浓度为0.5-1 mM)以减少渗漏去酯化指标。
d)将等体积的染料工作溶液(来自步骤b或c)加入细胞板中。
e)将染料加载板在细胞培养箱中孵育60至90分钟,然后在室温下将板孵育另外30分钟。
注意:孵育染料超过2小时可以为某些细胞系提供更好的信号强度。
f)用HHBS或您选择的缓冲液(含有阴离子转运蛋白抑制剂,如1mM丙磺舒,如果适用)替换染料工作溶液,以去除多余的探针。
g)在Ex / Em = 490 / 525nm(对于Cal-520 AM),540 / 5000nm(对于Cal-590 AM)或600 / 640nm(对于Cal-630 AM)进行实验。
2.测量细胞内钙响应:
为了确定溶液的游离钙浓度或单波长钙指示剂的Kd,使用以下等式:
[Ca]free = Kd[F ─ Fmin]/Fmax ─ F]
其中F是实验钙水平下指示剂的荧光,Fmin是不存在钙时的荧光,Fmax是钙饱和探针的荧光。
解离常数(Kd)是探针对钙的亲和力的量度。 与校准溶液相比,荧光指示剂的Ca结合和光谱性质在细胞环境中变化非常显着。 细胞内指标的原位反应校准通常产生显着高于体外测定的Kd值。 通过在离子载体如A-23187,4-溴A-23187和离子霉素存在下将加载的细胞暴露于受控的Ca2+缓冲液来进行原位校准。 或者,细胞透化剂如洋地黄皂苷或X-100可用于将指示剂暴露于细胞外培养基的受控Ca2+水平。
参考文献
Ratiometric analysis of fura red by flow cytometry: a technique for monitoring intracellular calcium flux in primary cell subsets
Authors: Wendt ER, Ferry H, Greaves DR, Keshav S.
Journal: PLoS One (2015): e0119532
A flow cytometric comparison of Indo-1 to fluo-3 and Fura Red excited with low power lasers for detecting Ca(2+) flux
Authors: Bailey S, Macardle PJ.
Journal: J Immunol Methods (2006): 220
Use of co-loaded Fluo-3 and Fura Red fluorescent indicators for studying the cytosolic Ca(2+)concentrations distribution in living plant tissue
Authors: Walczysko P, Wagner E, Albrechtova JT.
Journal: Cell Calcium (2000): 23
[Monitoring calcium in outer hair cells with confocal microscopy and fluorescence ratios of fluo-3 and fura-red]
Authors: Su ZL, Li N, Sun YR, Yang J, Wang IM, Jiang SC.
Journal: Shi Yan Sheng Wu Xue Bao (1998): 323
Calcium transient alternans in blood-perfused ischemic hearts: observations with fluorescent indicator fura red
Authors: Wu Y, Clusin WT.
Journal: Am J Physiol (1997): H2161
Problems associated with using Fura-2 to measure free intracellular calcium concentrations in human red blood cells
Authors: Blackwood AM, Sagnella GA, Markandu ND, MacGregor GA.
Journal: J Hum Hypertens (1997): 601
IgG-induced Ca2+ oscillations in differentiated U937 cells; a study using laser scanning confocal microscopy and co-loaded fluo-3 and fura-red fluorescent probes
Authors: Floto RA, Mahaut-Smith MP, Somasundaram B, Allen JM.
Journal: Cell Calcium (1995): 377
Improved sensitivity in flow cytometric intracellular ionized calcium measurement using fluo-3/Fura Red fluorescence ratios
Authors: Novak EJ, Rabinovitch PS.
Journal: Cytometry (1994): 135
Localization of calcium entry through calcium channels in olfactory receptor neurones using a laser scanning microscope and the calcium indicator dyes Fluo-3 and Fura-Red
Authors: Schild D, Jung A, Schultens HA.
Journal: Cell Calcium (1994): 341
The distribution of intracellular calcium chelator (fura-2) in a population of intact human red cells
Authors: Lew VL, Etzion Z, Bookchin RM, daCosta R, Vaananen H, Sassaroli M, Eisinger J.
Journal: Biochim Biophys Acta (1993): 152
