上海金畔生物科技有限公司代理AAT Bioquest荧光染料全线产品,欢迎访问AAT Bioquest荧光染料官网了解更多信息。
Cell Navigator 溶酶体标记试剂盒 近红外荧光价格 2823
产品规格
产品货号

| Ex (nm) | 636 | Em (nm) | 651 |
| 分子量 | – | 溶剂 | – |
| 存储条件 | 在零下15度以下保存, 避免光照 |
Cell Navigator 溶酶体标记试剂盒 近红外荧光是一套荧光成像工具,用于标记亚细胞细胞器,如膜,溶酶体,线粒体,细胞核等。活细胞区的选择性标记为研究空间细胞事件提供了一种强大的方法和时间背景。
该特定试剂盒设计用于在Ex / Em =630/650nm处以大斯托克斯位移的近红外荧光标记活细胞的溶酶体。该试剂盒使用专有的溶解性染料,可能通过溶酶体pH梯度选择性地积聚在溶酶体中。溶致指示剂,一种疏水性化合物,很容易渗透完整的活细胞,并被困在溶酶体内。进入溶酶体后,其荧光显着增强。这一关键特征显着降低了其染色背景,使其可用于多种研究,包括细胞粘附,趋化性,多药耐药性,细胞活力,细胞凋亡和细胞毒性。该套件提供所有必要组件。 它适用于悬浮细胞和贴壁细胞。Cell Navigator 溶酶体标记试剂盒 近红外荧光 是美国AAT Bioquest研发的产品。
适用仪器
| 荧光显微镜 | |
| Ex: | 630 nm |
| Em: | 650 nm |
| 推荐孔板: | 黑色透明底板 |
| 通道: | Cy5 通道 |
分析方案
概述
准备细胞
添加染料工作溶液
在37°C孵育30分钟至2小时
在荧光显微镜下Ex / Em = 630 / 650nm(Cy5滤光片组)处进行分析
操作方法
1.准备溶酶体染色溶液:
1.1解冻LysoBrite NIR(组分A)至室温。
1.2通过将20μLLysoBrite NIR(组分A)稀释到10mL活细胞染色缓冲液(组分B)中制备染料工作溶液。
注1:对于一个96孔板,20μLLysoBrite NIR(组分A)就足够了。 将未使用的LysoBrite NIR(组分A)等分并储存在<-20℃。 避光,避免反复冻融循环。
注2:荧光溶酶体指示剂的浓度根据具体应用而变化。 可以根据特定细胞类型和细胞或组织对探针的渗透性来修改染色条件。
2.准备和染色细胞:
2.1对于贴壁细胞:在96孔黑色壁/透明底板(100μL/孔/ 96孔板)中或在装有适当培养基的培养皿内的盖玻片上培养细胞。当细胞达到所需的汇合时,加入等体积(如100μL/孔/ 96孔板)的染料加工溶液(来自步骤1.2)。将细胞在37℃,5%CO2培养箱中孵育30分钟至2小时。使用配有Cy5滤光片的荧光显微镜观察细胞。
注意:如果细胞看起来没有充分染色,建议增加标记浓度或孵育时间以使染料积累。
2.2对于悬浮细胞:以1,000rpm离心细胞5分钟以获得细胞沉淀并吸出上清液。在预热的生长培养基中轻轻重悬细胞沉淀,然后加入等体积的染料加工溶液(来自步骤1.2)。将细胞在37℃,5%CO2培养箱中孵育30分钟至2小时。使用配有Cy5滤光器的荧光显微镜观察细胞。
注1:如果细胞看起来没有充分染色,建议增加标记浓度或培养时间以使染料积累。
注2:悬浮细胞可以附着在用BD Cell-Tak®(BD Biosciences)处理过的盖玻片上,并作为贴壁细胞染色(见步骤2.1)。
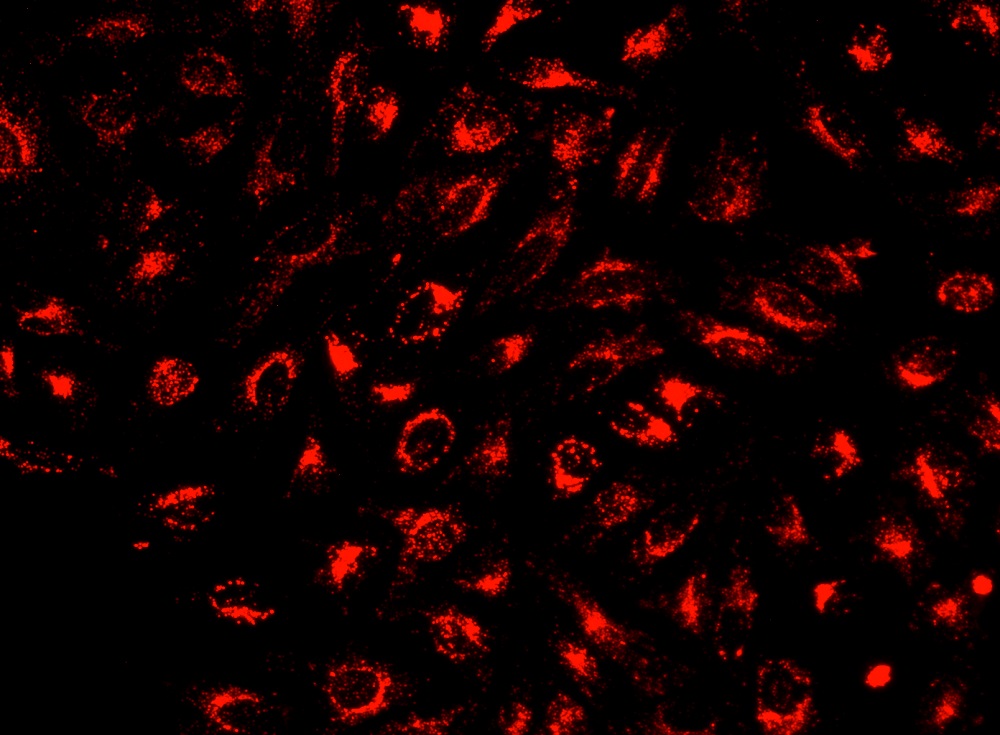
图1.使用具有Cy5过滤器组的Olympus荧光显微镜在Costar黑色96孔板中用Cell Navigator TM溶酶体染色试剂盒染色的Hela细胞的图像。
参考文献
A Triple-Fluorophore Labeled Nucleic Acid pH Nanosensor to Investigate Non-Viral Gene Delivery
Authors: David R Wilson, Denis Routkevitch, Yuan Rui, Arman Mosenia, Karl J Wahlin, Alfredo Quinones-Hinojosa, Donald J Zack, Jordan J Green
Journal: Molecular Therapy (2017)
Silica-based nanoparticles as bi-functional and bi-modal imaging contrast agents
Authors: Séverine Lechevallier, Robert Mauricot, Hélène Gros-Dagnac, Sylviane Chevreux, Gilles Lemercier, Erick Phonesouk, Muriel Golzio, Marc Verelst
Journal: ChemPlusChem (2017)
Decidua-derived mesenchymal stem cells as carriers of mesoporous silica nanoparticles. In vitro and in vivo evaluation on mammary tumors
Authors: Juan L Paris, Paz de la Torre, Miguel Manzano, M Victoria Cabanas, Ana I Flores, María Vallet-Regí
Journal: Acta biomaterialia (2016): 275–282
Rhodamine bound maghemite as a long-term dual imaging nanoprobe of adipose tissue-derived mesenchymal stromal cells
Authors: Vratislav Cmiel, Josef Skopalik, Katerina Polakova, Jan Solar, Marketa Havrdova, David Milde, Ivan Justan, {cmiel2016rhodamine Magro
Journal: European Biophysics Journal (2016): 1–12
Endocytosed β2-microglobulin amyloid fibrils induce necrosis and apoptosis of rabbit synovial fibroblasts by disrupting endosomal/lysosomal membranes: a novel mechanism on the cytotoxicity of amyloid fibrils
Authors: Tadakazu Okoshi, Itaru Yamaguchi, Daisaku Ozawa, Kazuhiro Hasegawa, Hironobu Naiki
Journal: PloS one (2015): e0139330
Fluorescence Imaging of siRNA Delivery by Peptide Nucleic Acid-based Probe
Authors: Takaya Sato, Yusuke Sato, Kenta Iwai, Shusuke Kuge, Norio Teramae, Seiichi Nishizawa
Journal: Analytical Sciences (2015): 315–320
The consideration of indolicidin modification to balance its hemocompatibility and delivery efficiency
Authors: Ching-Wei Tsai, Wei-Wen Hu, Chih-I Liu, Ruoh-Chyu Ruaan, Bing-Chang Tsai, Shiow-Lian Catherine Jin, Yung Chang, Wen-Yih Chen
Journal: International journal of pharmaceutics (2015): 498–505
A monitoring method for Atg4 activation in living cells using peptide-conjugated polymeric nanoparticles
Authors: Kyung-mi Choi, Hae Yun Nam, Jin Hee Na, Seong Who Kim, Sang Yoon Kim, Kwangmeyung Kim, Ick Chan Kwon, Hyung Jun Ahn
Journal: Autophagy (2011): 1052–1062
