免疫荧光 (IF)介绍
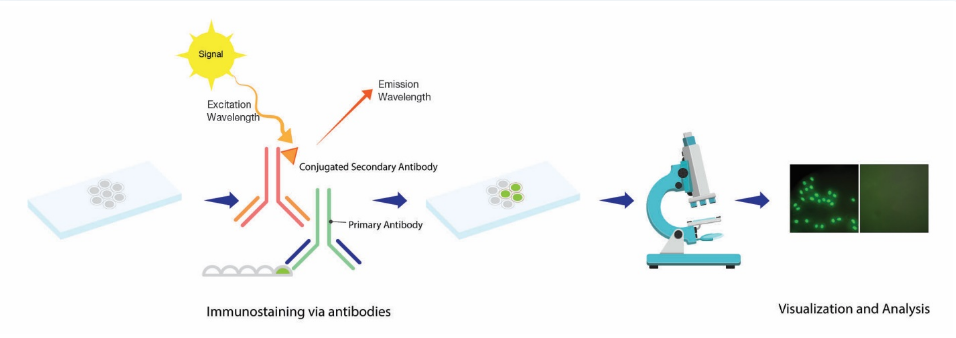
免疫荧光是一种免疫染色技术,可使用荧光显微镜观察样品中的抗原。使用有机溶剂和化学交联剂仔细固定样品,以保持其细胞完整性以及亚细胞结构。然后对它们进行透化以进行免疫染色,然后进行封闭以尽量减少非特异性结合。然后用抗体对样品进行免疫染色,并通过荧光反应使目标颜色可视化。
材料
-
10X PBS:要制备 1L,将 80g NaCl、2g KCl、2g KH2PO4 和 28.5g NaHPO4 添加到 1L 注射用水中。将 pH 值调整至 7.4。
-
4% 聚甲醛:要制备 100mL,将 4g 聚甲醛添加到 100mL 1×PBS 中。将 pH 值调整至 7.4。
-
1×PBS/0.2% Triton X-100(PBS/Triton):要制备 500mL,将 1mL Triton X-100 添加到 500mL 1× PBS 中。
-
1×PBS/3% BSA(PBS/BSA):配制100mL时,将3g BSA加入到100mL 1×PBS中。
协议
准备 固定 透化
-
在 PBS 中短暂冲洗细胞。
-
吸出PBS,用4%聚甲醛覆盖细胞至2-3mm深度约200ul。
-
让细胞在室温下固定 15 分钟。
-
吸出固定液,用 PBS 冲洗 3 次,每次 5 分钟。
-
吸出PBS,用PBS/Triton在室温下将细胞覆盖至2-3mm深度约200ul 5分钟。
-
吸出渗透剂在 PBS 中冲洗 3 次,每次 5 分钟。
免疫染色
-
将 200ul 用 PBS/BSA 稀释的一抗轻轻添加到 24 孔板的每孔中。
-
37℃ 孵育 60 分钟或 4℃ 过夜。
-
吸出稀释的一抗,然后在 PBS 中冲洗 3 次,每次 5 分钟。
-
将用 PBS/BSA 稀释的荧光染料偶联二抗加入到 24 孔板中,每孔 100ul,室温避光孵育 30 分钟。
-
吸出稀释的荧光染料偶联二抗,然后在 PBS 中冲洗 3 次,每次 5 分钟。
-
在荧光显微镜下测试。
