人干扰素α ELISA 血浆基质研究
通过酶联免疫吸附测定 (ELISA) 准确检测血清或血浆样品中的干扰素 (IFN) 会受到血清或血浆中成分(如异嗜性抗体和凝血因子)的干扰。 来自这些不同成分的干扰被称为基质效应。 在这种情况下,为了评估 ELISA 试剂盒的性能,将已知浓度的 IFN 添加到无 IFN 的血浆中,并确定 ELISA 检测到的浓度与实际量之间的百分比差异。 这被称为尖峰恢复。 在这项研究中,我们描述了使用在不同抗凝剂中纯混合血浆中制备的参考标准曲线的相容性研究。 本技术说明中还报告了我们使用不同批次的人血浆对人 IFN α 加标回收的结果。
介绍
ELISA 测定基于靶分子(分析物/抗原)与特异性识别靶标的抗体的结合。 使用二抗酶联抗体检测抗原-抗体复合物的存在。 通过添加产生可量化信号的底物获得检测。 通过使用不同的样品稀释剂对已知浓度的分析物进行系列稀释来制备标准曲线。 然后使用曲线的非线性 4 参数拟合来计算相似稀释剂中未知样品的浓度。 待测分析物可存在于不同的稀释剂中,例如含血清的组织培养基、纯血清、纯血浆和盐缓冲液。 在待测分析物存在于血清或血浆中的情况下, 由于血清蛋白、异嗜性抗体和/或凝血因子的存在,可能会干扰测定。 这可能会导致检测到误报、漏报或高背景。 在这项研究中,我们展示了通过使用 PBL 的 VeriKine Human Alpha 多亚型血清 ELISA 试剂盒 41110 平均大于 70% 的低浓度人干扰素 (IFN) α 实际浓度,可在人血浆中检测到。 我们还表明,未发现低浓度 IFN 的假阳性和假阴性,并且不存在空白的高信号。 此外,我们证明标准曲线 (500-12.5 pg/ml) 在样品稀释剂中预稀释至 50% 的混合血浆中制备,或在样品制备后稀释的纯混合血浆中制备 2 X 标准曲线 (1000-25 pg/ml)稀释至 500-12.5 pg/ml 没有显着差异。
方法与分析
标准曲线是从 1000 pg/ml-25 pg/ml 的样品稀释液、3 批不同抗凝剂(柠檬酸钠、EDTA 钠和肝素钠)中的正常人血浆和三批混合液中制备的。 此外,在两个不同批次的正常人血浆中制备了低 (30 pg/ml)、中 (300 pg/ml) 和高 (800 pg/ml) 加标物。 这两个地段不是来自游泳池中使用的地段。 在此之后,将 50 μl 标准品添加到产品41110-1 中提供的板上的 50 μl 样品稀释液中 人干扰素α血清样品多亚型 ELISA 试剂盒。 ELISA 的其余步骤按照试剂盒方案进行。 在单独的测定中,比较了 1000-25 pg/ml 混合人血浆的标准曲线和 500-12.5 pg/ml 50% 混合人血浆稀释于样品稀释剂中的标准曲线。 在此测定中,将混合人血浆中的 50 μl 标准品 (1000-25 pg/ml) 添加到板上的 50 μl 样品稀释剂中,如果是 50% 混合血浆中的标准品 (500-12.5 pg/ml)将 100 μl 直接加载到板上。 每次测定完成后,在Vmax 上以 450 nm 读取板 酶标仪(Molecular Devices Corporation,CA)。 针对每条曲线绘制 Y 轴上的平均 OD @ 450nm 与 X 轴上以 pg/ml 为单位的实际浓度。 使用非线性 4 参数拟合生成曲线(图 1-5)。
基于数据点的曲线拟合方程和平均 OD 值,确定每个数据点的外推浓度(反拟合浓度)。 使用 SoftMax Pro 版本 5 (Molecular Devices Corporation, CA) 分析所有数据。
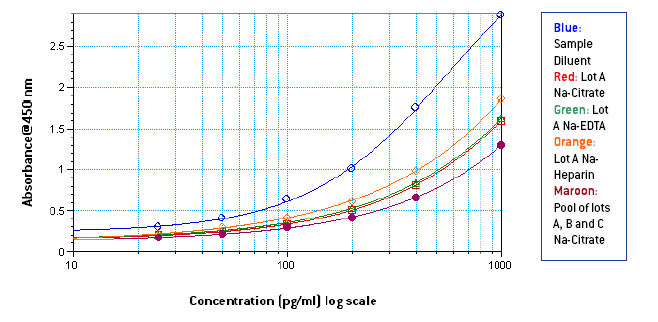
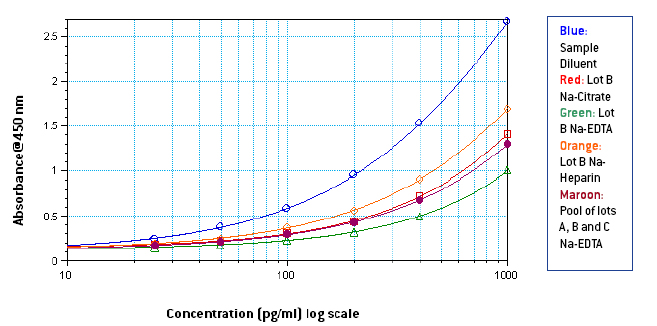
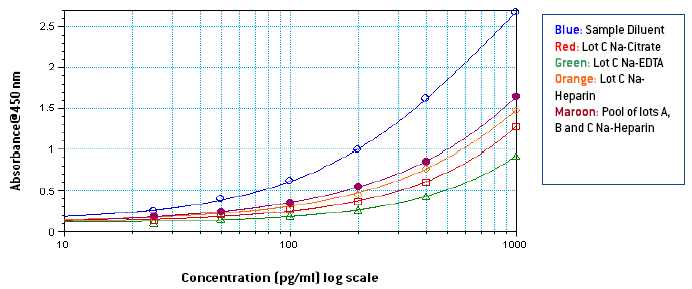
图 1-3: 样品稀释液中 1000-25 pg/ml 的标准曲线,3 个不同批次的纯血浆和使用 3 个不同批次和不同抗凝剂的纯混合血浆
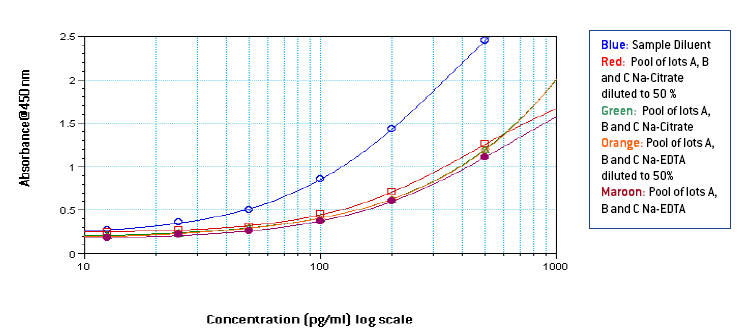
图 4-5: 在样品稀释液中制备的 500-12.5 pg/ml 和 50% 混合血浆的标准曲线与在样品稀释剂中稀释至 500-12.5 pg/ml 的纯混合血浆中的 1000-25 pg/ml 的标准曲线相比较
表 1: 不同抗凝剂中人血浆 中人 IFN α A2a 的加标回收率百分比
% 加标回收率
> 矩阵 30皮克/毫升 300皮克/毫升 800皮克/毫升
含柠檬酸钠的 Lot D 61.2% 102.2% 91.5%
含柠檬酸钠的 Lot E 79.1% 122.5% 127.5%
含有 Na-EDTA 的批次 D 60.6% 84.7% 76.81%
含 Na-EDTA 的 Lot E 58.6% 86.96% 91.23%
Lot D 与肝素钠 91.88% 107.68% 94.88%
Lot E 与肝素钠 98.76% 105.32% 106.53%
平均的 75% 101.56% 98.1%
从图 1-3 可以看出,Na-EDTA 人血浆中的信号低于 Na-Citrate 和 Na-Heparin 人血浆中的信号。 这种效应在混合血浆中也很明显。 肝素钠血浆中的信号在三种抗凝剂中比较强 。 与样品稀释液中的信号相比,由于血浆中的成分,人血浆中的信号也很明显受到抑制。 从图 4-5 中可以看出,根据平板上相应最终浓度的 IFN Alpha 的 OD,在未稀释的混合血浆中制备了 1000-25 pg/ml 的标准曲线,其中添加了 50 μl 曲线无论使用何种抗凝血剂,50 μl 样品稀释液在平板上类似于在 50% 混合血浆中制备的 500-12.5 pg/ml 的标准曲线。 然而, 由于来自不同供体的血浆中成分的数量和差异不同,两条曲线之间的相似程度可能因血浆批次而异。 从表 1 中可以看出,低浓度加标 IFN Alpha A 2a (30 pg/ml) 的加标回收率在含 EDTA 钠的血浆中 较小,在含肝素钠的血浆中最高。 总体而言,平均加标回收率在可接受的行业标准范围内。
结论
为了准确测定血浆中人干扰素α的浓度,未知血浆样品必须在样品稀释液中按 1:2 稀释。 1:2 稀释之前的所有预稀释都应在含有相同抗凝剂的正常人血浆中进行。 样品的未知浓度必须从标准曲线 (1000-25 pg/ml) 中推断出来,该标准曲线是在具有不可检测量的内源性 IFN α 的正常人血浆中制备的,或者是一组不含内源性 IFN α 的血浆批次,并且 50 μl 曲线必须添加到板上的 50 μl 样品稀释液中。 使用产品 41110 从人血浆中回收的加标回收率确实因血浆批次而异。 为获得最准确的结果,加标回收率应根据在含有相同抗凝剂的混合血浆中绘制的标准曲线推断得出。 产品性能 41110 在以 Na-Heparin 作为抗凝剂的血浆样品中最好,在以 Na-EDTA 作为抗凝剂的血浆中最差。