谷氨酰胺代谢与癌症治疗
1935年,Hans Krebs提出了著名的三羧酸循环(TCA),指出了谷氨酰胺代谢在动物体内的重要性。随后的研究表明,谷氨酰胺在正常细胞和癌细胞的生长中发挥着重要作用。
鉴于谷氨酰胺在能量产生和大分子合成中发挥的关键作用,针对谷氨酰胺开发的相关药物在抑制肿瘤方面具有巨大潜力。接下来我们将介绍谷氨酰胺的生理作用以及抑制剂的临床进展。
谷氨酰胺代谢
血液中高水平的谷氨酰胺提供了现成的碳源和氮源,以支持癌细胞的生物合成、能量代谢和体内平衡,从而促进肿瘤生长。
谷氨酰胺将准转运蛋白 SLC1A5(溶质载体家族 1 中性氨基酸转运蛋白成员 5)递送至细胞。
在营养缺乏的条件下,癌细胞可以通过分解大分子来获取谷氨酰胺。
Oncogene RAS 促进胞饮作用,在胞饮作用中,癌细胞去除细胞外蛋白质并将其分解为氨基酸,为癌细胞提供营养。
癌细胞吸收大量葡萄糖,但大部分碳源通过有氧糖酵解产生乳酸,而不是用于TCA循环。
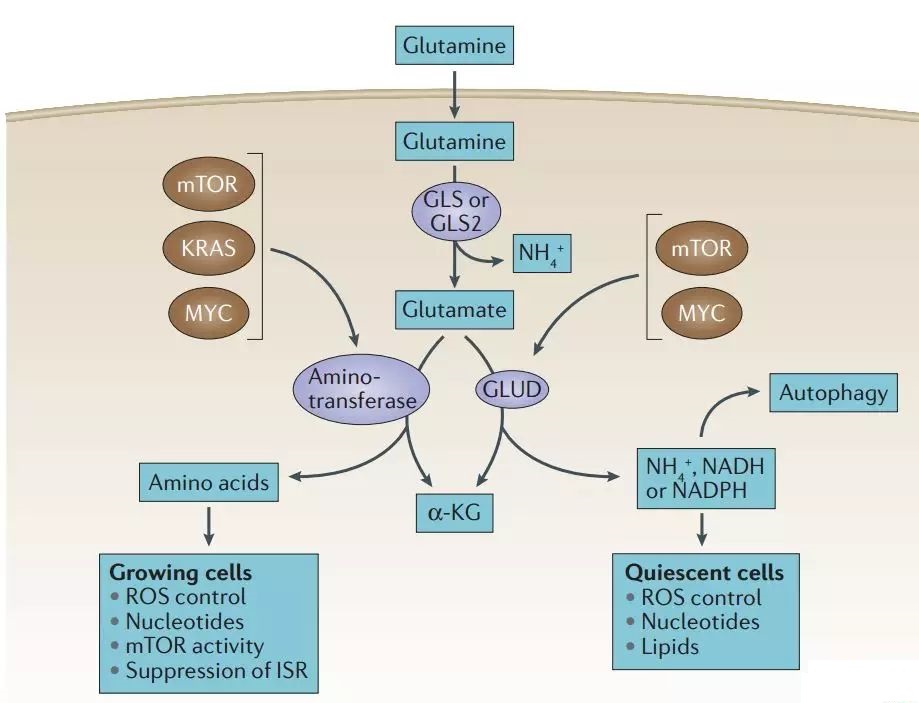
过度激活 PI3K、Akt、mTOR、KRAS 基因或 MYC 通路的肿瘤细胞通过谷氨酰胺酶 (GLUD) 或转氨酶的催化,刺激谷氨酸代谢产生 α-酮戊二酸。 α-酮戊二酸进入三羧酸(TCA)循环,可为细胞提供能量。
核酸、脂质和蛋白质中谷氨酰胺的合成
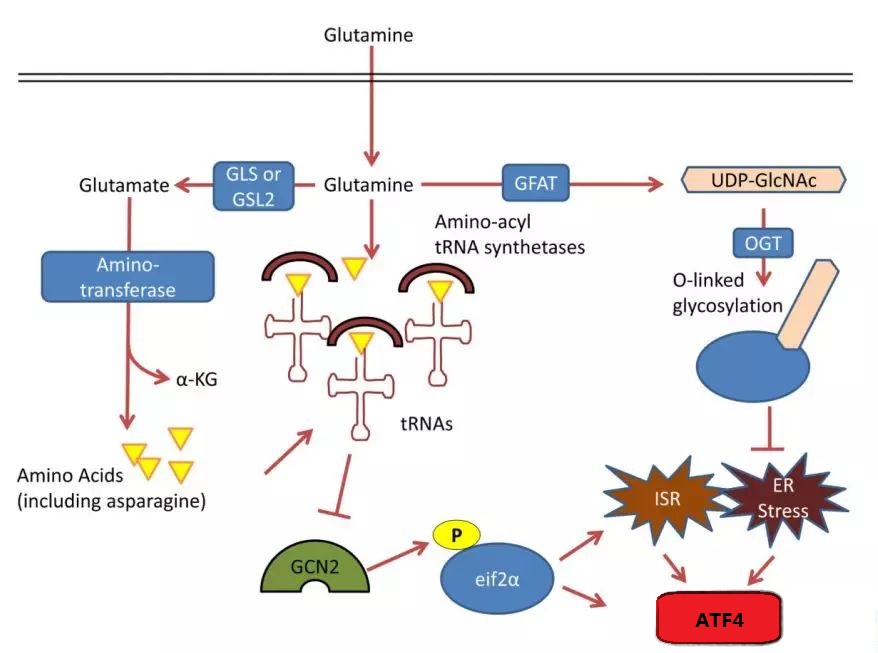
谷氨酰胺可作为细胞生长和分裂过程中生物合成的原料。谷氨酰胺中的碳可用于氨基酸和脂肪酸的合成,谷氨酰胺中的氮直接作用于嘌呤和嘧啶的生物合成。
核酸合成
TCA循环和氨基转移产生的天冬氨酸是嘌呤和嘧啶合成的关键碳源。缺乏谷氨酰胺的癌细胞将在细胞周期中停滞,并且不能通过 TCA 环状中间体(例如草酰乙酸)用于核酸合成。然而,补充外源核苷酸或天冬氨酸可以缓解谷氨酰胺缺乏引起的细胞周期停滞。
此外,谷氨酰胺依赖性 mTOR 信号可以激活氨基甲酰磷酸合酶 2、天冬氨酸转移酶和氨基甲酰天冬氨酸脱水酶 (CAD)。并催化谷氨酰胺衍生的氮进入嘧啶前体合成。
脂质合成
谷氨酰胺经谷氨酰胺酶(GLS或GLS2)催化生成谷氨酰胺酶,再经谷氨酰胺酶(GLUD)或转氨酶催化生成α-酮戊二酸。 α-酮戊二酸通过催化乙酰辅酶A的反向生成,可用于直接脂质合成。
蛋白质合成
除了谷氨酰胺中的碳用于氨基酸合成外,谷氨酰胺还在蛋白质合成中发挥着关键作用。谷氨酰胺的缺乏会导致蛋白质折叠和内质网应激反应不正确。
谷氨酰胺可由尿苷二磷酸乙酰氨基葡萄糖(UDP-GlcNAc)合成。 UDP-GlcNAc是β-O-乙酰转移酶(OGT)的底物,在内质网中的蛋白质折叠中发挥重要作用。
GCN2 是一种丝氨酸-苏氨酸激酶,调节结构域片段,与组氨酸 -tRNA 合酶类似。谷氨酰胺和组氨酸-tRNA 合成酶的结合会抑制 GCN2 酶的活性。后者在综合应激反应中起着重要作用。
谷氨酰胺和自噬
自噬与谷氨酰胺的关系错综复杂,这也体现在自噬在肿瘤发生发展中的作用。
肿瘤中自噬最矛盾的是:在某些情况下,它会导致染色体不稳定,并通过抑制氧化应激来抑制肿瘤的发展。自噬还可以通过促进胞饮作用和抑制 p53 等应激途径支持癌细胞的生存。
谷氨酰胺抑制GCN2的激活和综合应激。谷氨酰胺产生的氨可以通过自分泌和旁分泌方式促进自噬的发展。
ROS可以诱导自噬作为应激反应,但会被谷氨酰胺代谢产生的谷胱甘肽和NADPH中和。谷氨酰胺还可以间接刺激 mTOR,进而通过复杂的机制抑制自噬。
谷氨酰胺和活性氧
活性氧(ROS)介导的细胞信号在一定的生理水平下可以促进肿瘤的发展,但当水平过高时,活性氧会对细胞内的大分子造成很大的损伤。 ROS 通过多种方式产生,其中线粒体电子传递链会产生超氧 (O2−) 阴离子。
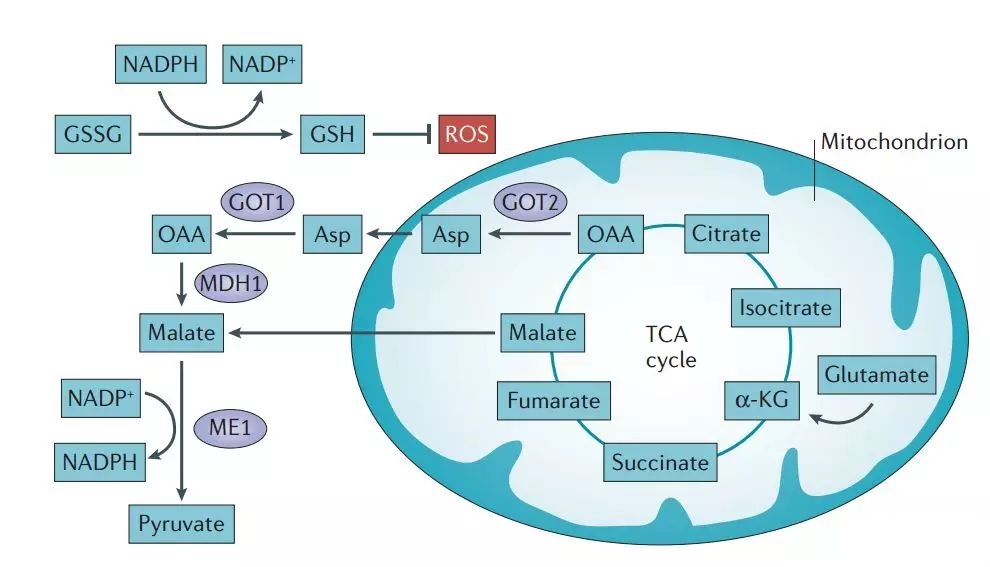
肿瘤可以通过谷氨酰胺代谢途径产生的产物来控制ROS的水平,防止高水平的ROS引起染色体不稳定。其中,谷氨酰胺控制活性氧最重要的途径是谷胱甘肽的合成。谷胱甘肽是一种可用于中和过氧自由基的三肽。
谷氨酰胺还可以通过 NADPH 影响活性氧的平衡。谷氨酰胺经过一系列反应产生的苹果酸,在苹果酸酶的催化下生成NADPH,用于调节ROS的平衡。
谷氨酰胺酶抑制剂的临床
肿瘤细胞对谷氨酰胺代谢的依赖性使其成为潜在的抗癌靶点。许多谷氨酰胺代谢的化合物,从最初的转运到随后转化为α-酮戊二酸,已成为研究热点。
尽管大多数仍处于临床前“工具合成”阶段或受到化合物毒性的限制,但谷氨酰胺酶变构抑制剂(GLS)已在临床前癌症模型中显示出巨大潜力。一种非常活跃的化合物CB-839,已进入临床试验。
人体内的谷氨酰胺酶主要有两种类型:肾型谷氨酰胺酶(GLS)和肝型谷氨酰胺酶(GLS2)。
肿瘤细胞过度激活肾谷氨酰胺酶(GLS),GLS2主要作用于非癌细胞,催化谷氨酰胺的代谢。
谷氨酰胺在能量合成、大分子合成、GLS2激活、活性氧平衡等细胞功能中的多效作用使得GLS抑制剂在联合治疗中发挥协同作用。
谷氨酰胺酶基因的抑制可以阻止上皮细胞向间质细胞的转化。此步骤是肿瘤细胞侵袭和最终转移的关键步骤。因此,预防转移可能是GLS抑制剂在与抑制谷氨酰胺代谢的联合治疗中发挥抗癌作用的重要作用。
如今,肿瘤免疫也成为最有前途的治疗方法,例如通过阻断免疫检查点PD抗体或使用工程嵌合抗原受体(CAR)T细胞。
这些方法需要免疫细胞在肿瘤微环境中发挥作用,体内的代谢抑制剂也可能广泛影响免疫功能。最近的研究表明,免疫细胞与癌细胞竞争葡萄糖,谷氨酰胺也可能具有类似的机制。
事实上,谷氨酰胺代谢在T细胞的激活和CD4+T细胞向炎症亚型转化的调节中发挥着重要作用。
谷氨酰胺对于癌症杀伤 T 细胞的激活过程至关重要。通过阻断癌细胞内的谷氨酰胺途径,增加肿瘤微环境中氨基酸的含量,增强免疫细胞的杀伤作用。
结论
九十年前,瓦尔堡发现许多动物和人类肿瘤对葡萄糖有非常高的亲和力,将大量葡萄糖分解成乳酸。他还指出,癌症是由代谢变化和线粒体功能丧失引起的。
人们重新发现了线粒体生理氧化功能对于癌症的重要性。而且谷氨酰胺在肿瘤细胞的生长中也发挥着重要作用。这些武断的观点在过去的几十年里已经被取代和完善。
谷氨酰胺在细胞功能中的多效性作用,如能量合成、大分子合成、mTOR 激活和活性氧平衡。
肿瘤细胞过度激活肾谷氨酰胺酶(GLS),而正常细胞催化谷氨酰胺代谢的是肝谷氨酰胺酶(GLS2)。临床上有可能选择性开发GLS抑制剂。
靶向抑制某些癌基因使肿瘤细胞对谷氨酰胺产生依赖,因此靶向抑制剂与谷氨酰胺代谢相结合具有合成致死作用。
由于肿瘤发病机制的复杂性,谷氨酰胺在人体内的生理机制尚不清楚。例如,13年清华大学施一公教授指出,谷氨酰胺代谢的主要作用是利用生成的胺来对抗肿瘤的酸性环境。因此,GLS抑制剂与其他靶点的联合应用已成为发展趋势。