可电离脂质的应用——RNA 递送
可电离脂质是一类有机脂质分子,在生理 pH 值下呈中性,在酸性 pH 值下呈质子化 (+)。可电离的脂质与磷脂、胆固醇和聚乙二醇化脂质一起构成脂质纳米颗粒 (LNP) 的结构。
可电离脂质在 LNP 中发挥作用,可保护 RNA 免受水解、核酸酶、pH 突然变化和氧化损伤的降解,以促进其胞质转运(图 1)。本质上,可电离脂质有助于促进 RNA 递送至靶细胞。
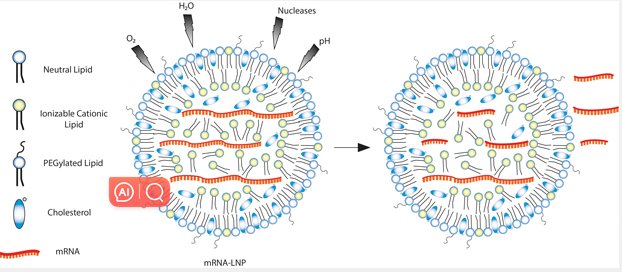
图 1:LNP 复合物中的可电离脂质发挥作用,促进 mRNA 胞质转运至靶细胞中。
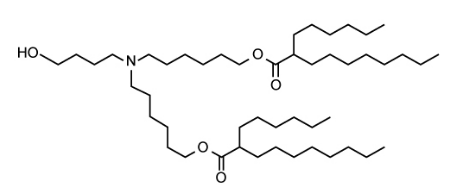
从结构上看,目前有五种主要的可电离脂质类型广泛用于 RNA 递送;不饱和、多尾、聚合、可生物降解和支化尾(表 1)。
不饱和可电离脂质通过增加双层脂质形成非双层相的倾向来增强膜破坏,以及随后的有效负载释放。双层脂质的这种转变趋势是尾部饱和度从 0 个顺式双键增加到 2 个顺式双键的结果。例如,MC3(表 1,第 1 行)的每个尾部都有两个顺式双键,MC3证明了不饱和可电离脂质能够增强 LNP 将 RNA 递送至靶细胞的能力,从而重新点燃了治疗学中 RNA 递送的热情,特别是 mRNA 疫苗。
多尾可电离脂质通过产生增加尾部区域横截面积的锥形 LNP 结构来增强内体破坏以及随后的 RNA 递送。因此,在使用此类脂质的同时优化 LNP 结构可以提高 RNA 效力。例如,C12-200(表 1,第 2 行)是一种多尾离子化脂质,与标准制剂相比,mRNA 表达量增加了 7 倍。这种使用多尾可电离脂质的优化配方被用于各种 mRNA 递送目的,特别是产前蛋白质替代疗法。
聚合可电离脂质通过疏水聚集增强颗粒形成,从而增强 RNA 递送。这种通过疏水聚集的增强是通过将游离胺取代到具有烷基尾部的阳离子聚合物上来实现的。例如,G0-C14(表 1,第 3 行)通过赋予肿瘤中各种 RNA 治疗剂的高积累/效力和有效转染,证明了 LNP 在癌症治疗中的前景。
![]()
可生物降解的电离脂质可减少细胞内 RNA 成功递送后的持续积累和毒性。这对于需要重复给药的 RNA 疗法尤其重要。这种降低的毒性是通过包含酯键来实现的,因为它们在生理pH下稳定,但在组织和细胞内会水解。例如,L319(表 1,第 4 行)是通过用酯键替换每个MC3尾部中的一个双键而制成的。这保持了 RNA 有效负载的效力,同时显示出宿主更好的耐受性。
支尾可电离脂质通过增强内体逃逸和增加脂质尾部的横截面积来增加 RNA 递送效力。由于 RNA 递送的多方面增强,支尾可电离脂质可有效递送大型 mRNA 构建体,用于蛋白质补充和碱基编辑疗法等。例如,FTT5(表 1,第 5 行)展示了具有酯链的支尾可电离脂质如何比其线性类似物具有更高的转染效率。与直链尾巴相比,支链尾巴的这种较高效率可能是由于支链可电离脂质上存在的仲酯的降解速率较慢。
作为脂质供应商,BroadPharm提供多种可电离脂质,例如ALC-0315类似物、SM-102类似物、MC3、C12-200等,为我们的客户在纳米颗粒药物输送方面的高级研究提供支持。