胰岛素高量程检测试剂盒详细介绍
高浓度胰岛素试剂盒专门用于定量高浓度细胞上清液样品中的胰岛素,无需执行稀释步骤。
概述
在测定中对胰岛素进行定量之前,通常需要稀释高度浓缩的样品。该 HTRF 高范围试剂盒无需清洗步骤,动态范围为 4 对数,可实现更低的样品稀释度和更高的准确度,从而实现简单可靠的胰岛素定量。
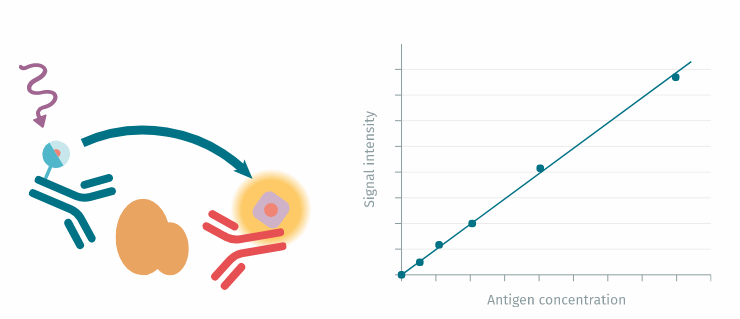
测定原理:使用两种单克隆抗体的夹心免疫测定法测量胰岛素,一种用 Cryptate(供体)标记,另一种用 XL665(受体)标记。获得的 FRET 信号强度与样品中胰岛素的浓度成正比。
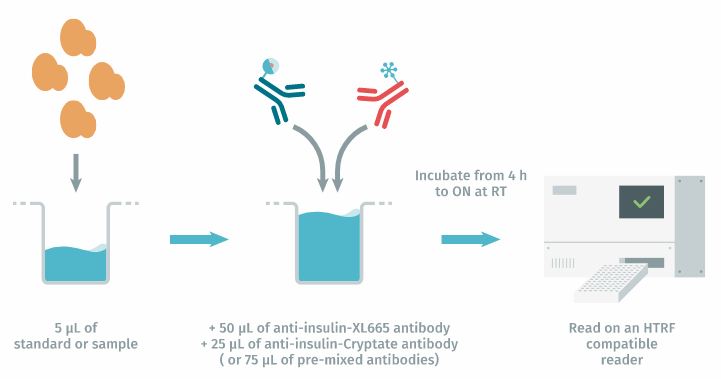
检测方案:5 µL 细胞上清液补充有 50 µL 受体标记抗体和 25 µL 供体标记抗体(或单个分液步骤中补充 75 µL 预混合试剂)。然后将混合物在室温下孵育 4 小时至过夜,并在 HTRF 兼容读取器上读取结果。
HTRF 高范围胰岛素测定显示与人胰岛上清液中的 RIA 具有好的相关性。回归线的斜率为 0.9,接近理想线,证明了测定的可靠性。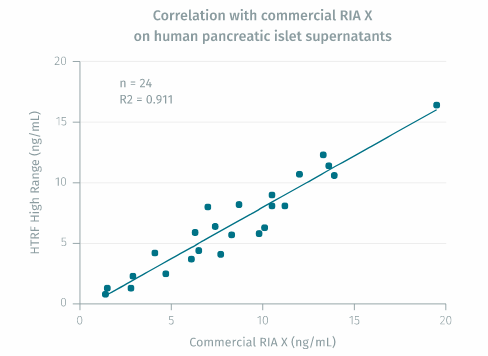
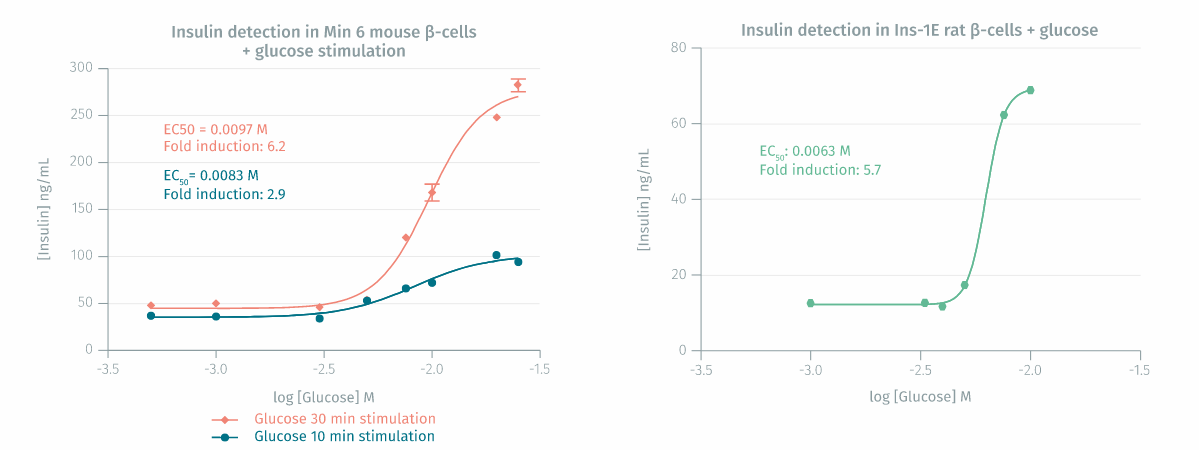
对小鼠和大鼠 B 细胞的验证:将 MIN6 小鼠 ß-细胞和 INS-1E 大鼠 ß-细胞接种到 24 孔板中(500 µL 培养基中,每孔 400,000 个细胞),然后在 37°C – 5% CO2 的全培养基中培养 6 天。刺激前,用 KRB 缓冲液洗涤细胞,并在 KRB 缓冲液(不含葡萄糖)中于 37°C 进行细胞静止步骤 2 小时。用 250 µL 含有浓度不断增加的葡萄糖的 KRB 缓冲溶液刺激细胞。MIN6 细胞分泌 10 分钟和 30 分钟后,或 INS-1E 细胞分泌 2 小时后,收集细胞上清液*并使用 HTRF 检测试剂对胰岛素进行定量。每个处理条件一式三份进行测量(误差线代表SEM)。
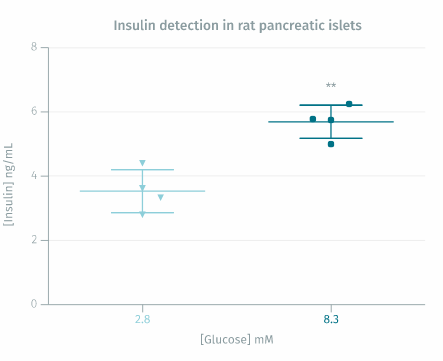
大鼠胰岛验证:将雄性 Wistar 大鼠新鲜分离的胰岛在含有 2.8 mM 葡萄糖(非刺激性基础条件)或 8.3 mM 葡萄糖(刺激性条件)的 KRB 缓冲液中于 37°C 孵育 30 分钟(5 个胰岛/管;4 管/健康)状况)。孵育期结束时,收集上清液*并使用胰岛素高范围试剂盒测定胰岛素浓度。
* 样品由法国蒙彼利埃大学糖尿病药理学实验室、Max Mousseron 生物分子研究所 (IBMM)、CNRS UMR-5247 药学院慷慨提供
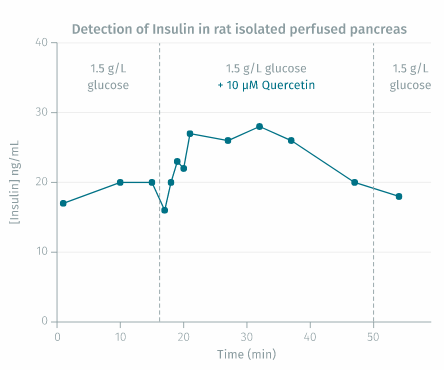
对离体灌注大鼠胰腺的验证:用含有 1.5 g/L 葡萄糖 +/- 10 µM 槲皮素的 KRB 缓冲液灌注从雄性 Wistar 大鼠中分离的胰腺。向培养基中连续通入 95% O2 ± 5% CO2 并保持在 37.5°C。选择恒定压力以提供 2.5 至 3.3 mL/min 之间的流速。随着时间的推移收集流出液*(13 个部分),并使用试剂盒试剂测量胰岛素浓度。
* 样品由法国蒙彼利埃大学糖尿病药理学实验室、Max Mousseron 生物分子研究所 (IBMM)、CNRS UMR-5247 药学院慷慨提供
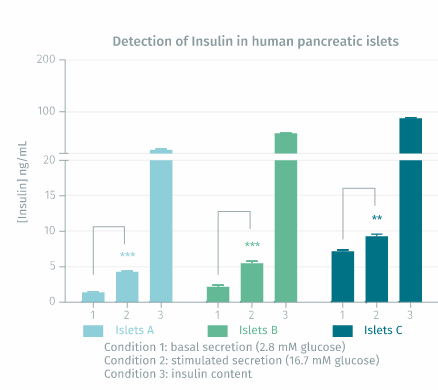
对人类胰岛的验证:将来自 3 个人胰腺(A、B 和 C)的胰岛置于 24 孔板中(50 个胰岛/孔,3 孔/条件),并在含有 2.8 mM 葡萄糖的 KRBH 缓冲液中于 37°C 预孵育 1 小时。孵育延长一小时并收集上清液以测量基础胰岛素分泌。接下来用 16.7 mM 葡萄糖在 37°C 下刺激胰岛 1 小时,然后收集上清液以测量葡萄糖刺激的胰岛素分泌。然后用酸-乙醇溶液裂解胰岛24小时,收集裂解物并离心。使用胰岛素高范围试剂盒试剂对上清液*和裂解物*中的胰岛素进行定量。
* 样本是在法国蒙彼利埃大学医院再生医学和生物治疗研究所 (IRMB) 糖尿病细胞治疗实验室生成的。