唾液采集之前要考虑什么问题?
唾液样本可以以方便、微创、可重复的方式采集。唾液是一种复杂的异质生物样本,如果收集不当可能会导致数据错误。然而,通过遵循正确的唾液采集和处理程序,可以从这种样本类型中获得高质量、可重复的数据。 收集唾液之前要考虑什么?
唾液成分的变异性
唾液中许多分析物的水平不会保持静态,浓度可能会因多种影响而发生变化 (1-5)。个体之间的样本也可能存在很大差异。根据感兴趣的分析物和研究的性质,有几个因素可能很重要:
-
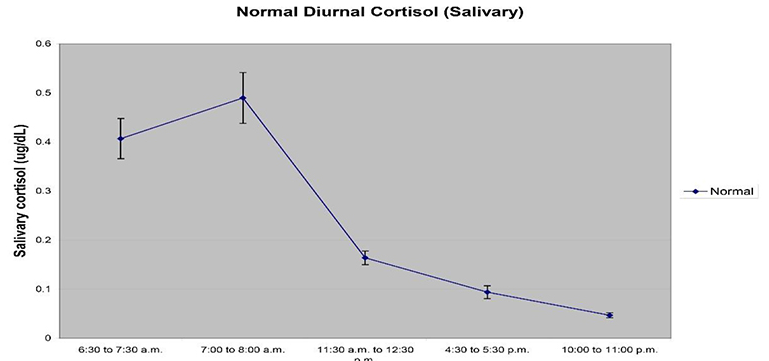
收集时间——大多数激素表现出昼夜节律的表达,对于某些唾液蛋白来说也是如此。基于皮质醇的研究尤其受到昼夜周期中皮质醇表达节律的影响,并且针对皮质醇昼夜表达的特定研究是研究设计的核心。我们建议查看文献中的最新建议或根据待测试的分析物向专家咨询具体建议。对于大多数研究来说,样本收集应该在特定时间或在一个时间窗口内进行,以获得最有意义的测量。
-
反应和恢复特征——如果研究涉及干预措施和压力源,则应定时收集样本以正确捕获反应。对于持续数月的较长间隔研究或测量压力反应的实验室压力源研究来说,情况确实如此。
口腔位置的影响(仅限拭子法)
吸收装置可能会收集局部唾液而不是整个唾液,这可能会影响某些分析物的结果。 α-淀粉酶和分泌型 IgA 等蛋白质的唾液水平确实根据口腔位置的不同而有所不同 (6-8)。我们建议将吸收装置放置在唾液聚集的位置。对于直立坐着的成人或儿童来说,口腔底部(舌头下方)是理想的位置。对于处于倾斜位置的婴儿、成人和儿童,我们建议将头转向一侧,并从“积聚”唾液的脸颊一侧收集唾液。当通过被动口水收集唾液时,我们建议让唾液积聚在舌下,并通过吸管状收集辅助装置轻轻地将收集到的口水推入管中。该样本还将代表从所有唾液腺收集的唾液,并消除从特定唾液腺收集唾液的任何偏差。
流量的影响
一些亲水性分析物(例如 DHEA-S 和/或较大蛋白质(例如 SIgA))的水平随着唾液流速的增加而降低,并且唾液 α-淀粉酶也可能受到类似影响 (9, 10)。目前,我们建议研究人员共同改变 α-淀粉酶、SIgA 和 DHEA-S 等分析物的分泌速率 (mL/min)。
记录收集所需唾液量所需的总时间,以便测定结果可以乘以流速(mL/分钟),以便将结果表示为分泌率(每单位时间的输出)。
示例 (SIgA):205.60 µg/mL x 1.33 mL/min = 273.45 µg/min
要确定使用吸收装置收集唾液时的流速,请在收集前后对拭子和储存管一起称重。 (唾液密度可假定为 1.0 g/mL 的近似值。)同时记录拭子在口腔中的时间长度,以便可以估计流速。
样本量和唾液刺激剂
现代免疫测定设计为使用小样本量(小于 100 µL),并且在大多数情况下,不需要刺激剂来收集足够的样本量。我们建议在收集唾液样本时不要使用口腔刺激剂,因为可能会导致测定干扰或某些分析物水平的改变 (11);目标应该是尽量减少唾液测试结果中不必要的变异来源。例如,即使咀嚼无味的石蜡/蜡也可能影响流量依赖性分析物。
如果刺激剂是绝对必要的(不使用刺激剂就无法收集唾液);
-
在整个研究过程中以一致的方式谨慎使用 (12)。
-
在使用口服刺激剂之前,考虑使用嗅觉或视觉刺激。
-
在实际收集之前尝试与研究参与者一起练习,以确保在实际研究收集之前熟悉该方法。
-
进行试点研究以确保口服刺激剂不会造成测定或分析物干扰 (11)。
在样品采集之前,请查看分析物采集方案或根据要执行的检测的数量和类型
结合唾液分析物和 DNA 分析
如果您计划在当前的研究中包括 DNA 分析,正在存档以供将来某个日期进行 DNA 分析,或者希望对之前存档的现有样本进行 DNA 分析
唾液中的血液污染
许多分析物在体循环中的水平高于唾液中的水平,并且在特定条件下血液污染可能是一个问题 (21-24)。我们建议如下:
我们建议如下:
-
参与者在样本采集前 45 分钟内不应刷牙 (23)。
-
样本采集前 24 小时内不应进行牙科工作。
-
研究参与者应该接受口腔健康问题或损伤的筛查。
-
明显被血液污染的唾液样本应丢弃并重新收集(22)。
-
从口腔健康问题高风险人群采集的样本可以使用 Salimetrics 血液污染检测试剂盒(Salimetrics 项目 1-1302;1-1302-5)进行筛查。
唾液收集设备注意事项
所使用的收集协议与待测试的分析物兼容至关重要。有些分析物只能用被动滴液收集的样品进行测试。使用拭子测量这些分析物可能会导致所测量的分析物回收率过高或过低。
并非所有拭子都是一样的。我们建议使用经过验证可用于测量目标分析物的拭子。一些制造商拥有专门针对皮质醇的拭子,并且仅针对皮质醇的测量进行了验证。使用此拭子测量另一种激素(例如睾酮)可能会导致错误的结果。使用棉花作为拭子材料已在文献中被证明是可变结果的来源,如果需要一致的结果且不被生物材料混淆,则不推荐使用棉花。 Salimetrics 已证实,来自棉花采集设备的数据通常与 Shirtcliff、EA 等人的论文(2001 年)被广泛引用的相匹配。然而,基于棉花的方法也会增加变异性,并提供与“真正的被动流口水”值显着不同的数据结果,如下图所示;
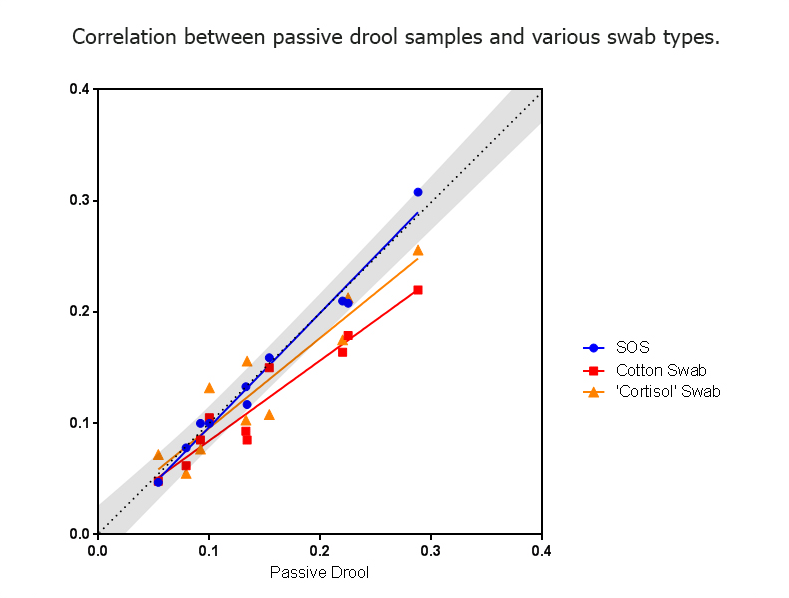
通过 SalivaBio 口腔拭子测量收集的唾液样本与通过被动流口水获得的样本非常接近。 N=10
保持分析物的完整性
在样品采集之前研究并遵循基本分析物稳定性和储存建议至关重要。仅使用高质量聚丙烯收集管和小瓶来储存样品。聚苯乙烯或其他未经验证的塑料管可能会对分析物的测量值产生不利影响。所有SalivaBio 收集管和小瓶均由优质聚丙烯制成。
Salimetrics 建议所有样品在采集后立即冷冻。然而,如果这是不可能的,研究人员应该考虑:
-
一些不稳定的分析物在室温下会快速变化(即肽和蛋白质)
-
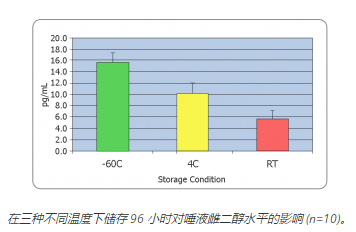
对于某些分析物,例如(脱氢表雄酮、黄体酮、雌二醇),应尽量减少冻融循环
Salimetrics是一家全球著名的唾液生物学研究领域专业产品供应商,其在唾液的收集方法、生物学性质及其(唾液中各生物组分的含量)定量检测技术拥有绝对的研发与产品供应优势。作为唾液生物学研究及诊断试剂盒应用领域的行业标准,其供应的唾液手机方案及唾液成分的ELISA检测试剂盒均专门唾液的理化性质所设计,可确保客户在科学研究或临床诊断中得到稳定、准确的唾液生物学信息,并同时具有操作简便、结果精确可靠、可重复性高、耗时少等诸多优点。Salimetrics的唾液检测实验室及拥有丰富的唾液生物学研发经验的专业团队可以为广大客户提供唾液生物学研究及诊断应用的专业指导。
