dTAG – 一种用于靶标确认的蛋白降解平台
什么是 dTAG?
dTAG(降解 TAG)是一种创新型靶标确认方法,该方法使用异双功能小分子降解剂来调控细胞的蛋白降解系统以及清除目标蛋白。dTAG 系统由 Dana Farber 癌症中心的 Behnam Nabet 博士及其同事共同开发,是一种可被广泛推广的方法,也是一种靶蛋白降解 (TPD)的方式。在开发降解剂的过程中,PROTAC ® MZ 1(类别号 6154)和 THAL SNS 032(类别号 6532)等其他 TPD 方法使用一种已与 E3 连接酶配体相连的靶蛋白的已知配体。dTAG 技术通过降解剂技术和基因组工程的结合,从而消除了对已知配体的需要。
dTAG 是如何工作的?
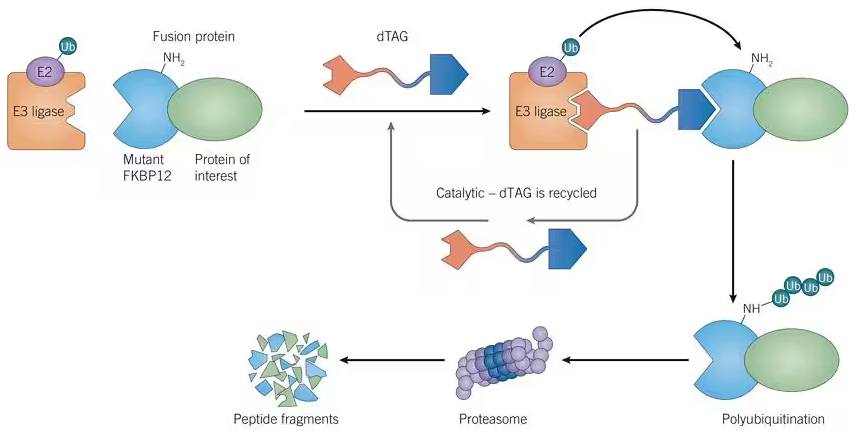
图 1:dTAG 的作用机理
通过CRISPR/Cas9 介导的基因座特异性敲入或慢病毒转基因表达,靶蛋白表达为一种具有 FKBP12F36V 突变体的嵌合体。dTAG-13(类别号 6605)等 dTAG 化合物由一个高选择性 FKBP12F36V 配体与 E3 连接酶配体连接组成,该配体在融合蛋白和 E3 连接酶之间形成一个三元复合体,从而引起靶蛋白多聚泛素化和降解。
在体外,dTAG-13 经证实会导致 BRD4-FKBP12F36V 的快速有效降解,但对内源性野生型 FKBP12、BRD2 或 BRD3 水平没有影响。为验证此方法,还将 dTAG 系统用于与 EZH2、HDAC1、KRAS、MYC 和 PLK1 融合的 FKBP12F36V 的蛋白嵌合体。还使用一种荧光素酶-FKBP12F36V 嵌合体在体内对 dTAG-13 的疗效进行了验证。这种融合蛋白最初在一种人白血病细胞系中表达,随后被移植到小鼠骨髓中。dTAG-13 会导致生物发光信号迅速减少,这表明其能有效降解荧光素酶-FKBP12F36V 嵌合体。
dTAG 在癌症中用于靶标确认
常规的靶标确认策略包括使用RNA 干扰 (RNAi) 或 CRISPR/Cas9破坏基因表达从而导致细胞总蛋白水平降低 ,或使用小分子拮抗剂抑制蛋白功能。小分子等药理学方法较单纯的基因方法具有许多优势,包括剂量依赖性效应以及快速且可逆的作用。相比之下,基因方法提供的动态控制较少、无法确定效应量且通常不可逆。使用 dTAG 进行靶标确认结合了基因和药理学策略的关键优势,能对细胞总蛋白丰度提供快速的剂量依赖性效应,而且这种效应在降解剂洗脱方面是可逆的。
dTAG-13 已被用来检测和验证癌症的新靶点。含有 YEATS 结构域的蛋白 ENL 是超级延伸复合体 (SEC) 的一部分,该复合体可通过增加 RNA 聚合酶在转录期间的催化速率来控制转录延伸级别的基因活动。该蛋白先前已被确定为急性髓系白血病 (AML) 中的一种关键蛋白,可通过维持基因表达失调来支持发病机制,然而,并无已知可用于 ENL 的配体。
为验证 ENL 作为 AML 中的一种靶标,Erb 等人将 ENL 表达为人体 AML 细胞系中的一种 FKBP12F36V 融合蛋白并在纳摩尔浓度下通过 dTAG-13 证实了 ENL 的选择性降解。这导致了转录起始和延伸的全基因组抑制以及细胞生长停滞。使用 dTAG-13 降解 ENL 的进一步研究表明其在 SEC 募集中发挥作用,并将 YEATS 结构域确定为一种对 ENL 依赖性细胞生长至关重要的染色质识别域的效应分子。