【简单介绍】
NameAnnexin V : PE Apoptosis Detection Kit IContentsAnnexin V-PE, 7-AAD, and Annexin V Binding BufferSize100 TestsRegulatory Status RUO
*,现货*格优惠,咨询
【详细说明】
Technical Data Sheet
PE Annexin V Apoptosis Detection Kit I
Product Information
Material Number: 559763
Component: 51-66121E
Description: 10X Annexin V Binding Buffer
Size: 50 ml (1 ea)
Storage Buffer: Aqueous buffered solution containing no preservative.
Component: 51-68981E
Description: 7-AAD
Size: 2.0 ml (1 ea)
Vol. per Test: 5 μl
Storage Buffer: Aqueous buffered solution containing fetal bovine serum and ≤0.09% sodium
azide.
Component: 51-65875X
Description: PE Annexin V
Size: 0.5 ml (1 ea)
Vol. per Test: 5 μl
Storage Buffer: Aqueous buffered solution containing BSA and ≤0.09% sodium azide.
Description
Apoptosis is a normal physiologic process which occurs during embryonic development as well as in maintenence of tissue homeostasis. The
apoptotic program is characterized by certain morphologic features, including loss of plasma membrane asymmetry and attachment,
condensation of the cytoplasm and nucleus, and internucleosomal cleavage of DNA. Loss of plasma membrane is one of the earliest features.
In apoptotic cells, the membrane phospholipid phosphatidylserine (PS) is translocated from the inner to the outer leaflet of the plasma
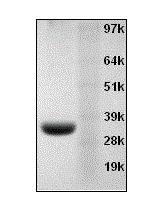
membrane, thereby exposing PS to the external cellular environment. Annexin V is a 35-36 kDa Ca2+ dependent phospholipid-binding
protein that has a high affinity for PS, and binds to cells with exposed PS. Annexin V may be conjugated to fluorochromes including
Phycoerythrin (PE). This format retains its high affinity for PS and thus serves as a sensitive probe for flow cytometric analysis of cells that are
undergoing apoptosis. Since externalization of PS occurs in the earlier stages of apoptosis, PE Annexin V staining can identify apoptosis at an
earlier stage than assays based on nuclear changes such as DNA fragmentation.
PE Annexin V staining precedes the loss of membrane integrity which accompanies the latest stages of cell death resulting from either
apoptotic or necrotic processes. Therefore, staining with PE Annexin V is typically used in conjunction with a vital dye such as
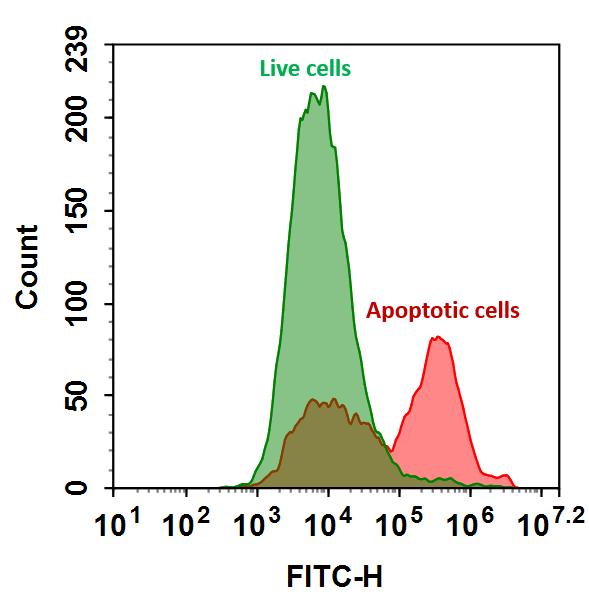
7-Amino-Actinomycin (7-AAD) to allow the investigator to identify early apoptotic cells (7-AAD negative, PE Annexin V positive). Viable
cells with intact membranes exclude 7-AAD, wheras the membranes of dead and damaged cells are permeable to 7-AAD. For example, cells
that are considered viable are PE Annexin V and 7-AAD negative; cells that are in early apoptosis are PE Annexin V positive and 7-AAD
negative; and cells that are in late apoptosis or already dead are are both PE Annexin V and 7-AAD positive. This assay does not distinguish
between cells that have undergone apoptotic death versus those that have died as a result of a necrotic pathway because in either case, the dead
cells will stain with both PE Annexin V and 7-AAD. However, when apoptosis is measured over time, cells can be often tracked from PE
Annexin V and 7-AAD negative (viable, or no measurable apoptosis), to PE Annexin V positive and 7-AAD negative (early apoptosis,
membrane integrity is present) and finally to PE Annexin V and 7-AAD positive (end stage apoptosis and death). The movement of cells
through these three stages suggests apoptosis. In contrast, a single observation indicating that cells are both PE Annexin V and 7-AAD
positive, in of itself, reveals less information about the process by which the cells underwent their demise.
559763 Rev. 8 Page 1 of 3
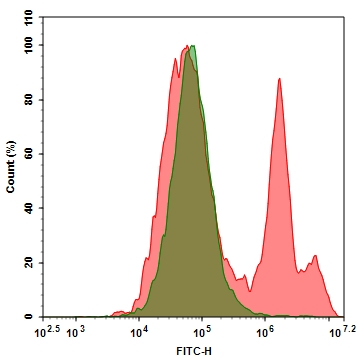
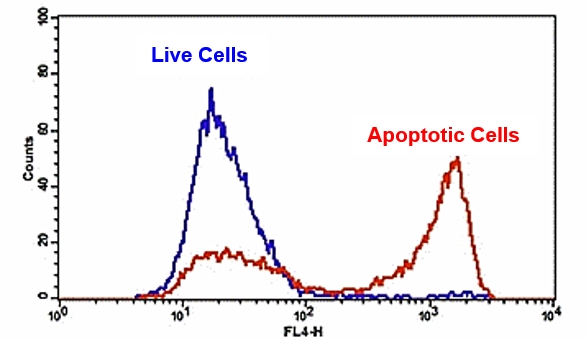
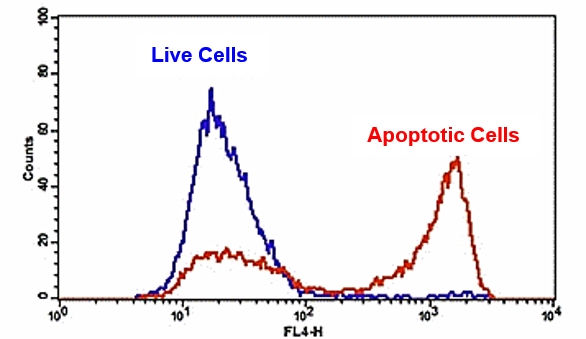
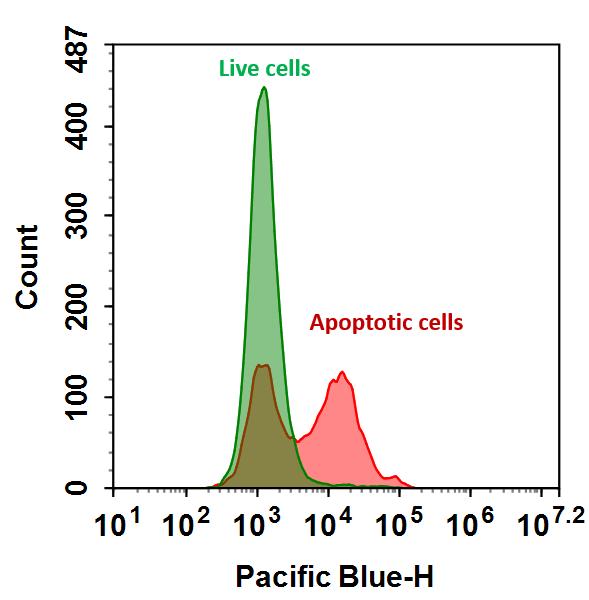
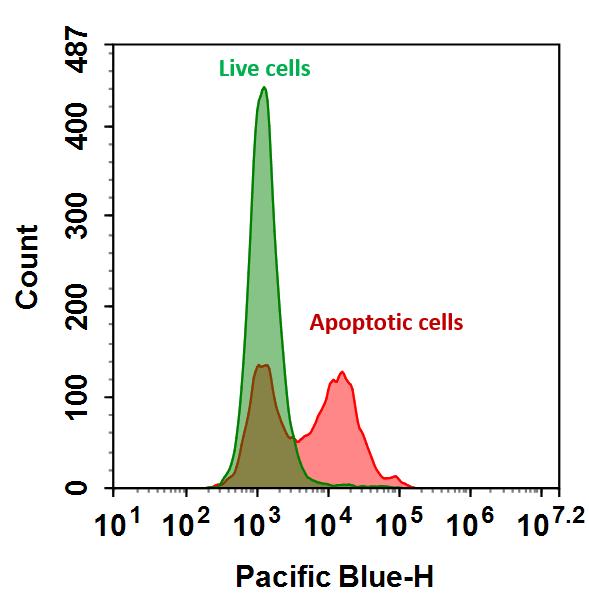
Flow Cytometric Analysis of PE Annexin V staining. Jurkat cells
(Human T-cell leukemia; ATCC TIB-152) were left untreated (top
panels) or treated for 4 hours with 4 μM Camptothecin (bottom
panels). Cells were incubated with PE Annexin V in a buffer
containing 7-Amino-Actinomycin (7-AAD) and analyzed by flow
cytometry. Untreated cells were primarily PE Annexin V and 7-AAD
negative, indicating that they were viable and not undergoing
apoptosis. After a 4 hour treatment (bottom panels), there were
primarily two populations of cells: Cells that were viable and not
undergoing apoptosis (PE Annexin V and 7-AAD negative); cells
undergoing apoptosis (PE Annexin V positive and 7-AAD negative).
A minor population of cells were observed to be PE Annexin V and
7-AAD positive, indicating that they were in end stage apoptosis or
already dead.
Preparation and Storage
Store undiluted at 4°C and protected from prolonged exposure to light. Do not freeze.
Application Notes
Application
Flow cytometry Routinely Tested
Recommended Assay Procedure:
PE Annexin V is a sensitive probe for identifying apoptotic cells, binding to negatively charged phospholipid surfaces (Kd of ~5 x 10^-2) with a
higher affinity for phosphatidylserine (PS) than most other phospholipids. PE Annexin V binding is calcium dependent and defined calcium and
salt concentrations are required for optimal staining as described in the PE Annexin V Staining Protocol. Investigators should note that PE
Annexin V flow cytometric analysis on adherent cell types (e.g HeLa, NIH 3T3, etc.) is not routinely tested as specific membrane damage
may occur during cell detachment or harvesting. Methods for utilizing Annexin V for flow cytometry on adherent cell types, however,
have been previously reported (Casiola-Rosen et al. and van Engelend et al.).
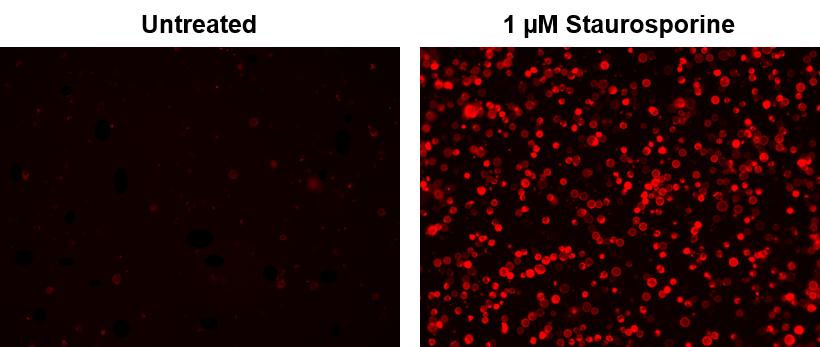
INDUCTION OF APOPTOSIS BY CAMPTOTHECIN
The following protocol is provided as an illustration on how PE Annexin V may be used on a cell line (Jurkat).
Materials
1. Prepare Camptothecin stock solution (Sigma-Aldrich Cat. No. C-9911): 1 mM in DMSO.
2. Jurkat T cells (ATCC TIB-152).
Procedure
1. Add Camptothecin (final conc. 4-6 μM) to 1 x 10^6 Jurkat cells.
2. Incubate the cells for 4-6 hr at 37°C.
3. Proceed with the PE Annexin V Staining Protocol to measure apoptosis.
PE ANNEXIN V STAINING PROTOCOL
PE Annexin V is used to quantitatively determine the percentage of cells within a population that are actively undergoing apoptosis. It relies on
the property of cells to lose membrane asymmetry in the early phases of apoptosis. In apoptotic cells, the membrane phospholipid
phosphatidylserine (PS) is translocated from the inner leaflet of the plasma membrane to the outer leaflet, thereby exposing PS to the external
environment. Annexin V is a calcium-dependent phospholipid-binding protein that has a high affinity for PS, and is useful for identifying
apoptotic cells with exposed PS. 7-Amino-Actinomycin (7-AAD) is a standard flow cytometric viability probe and is used to distinguish viable
from nonviable cells. Viable cells with intact membranes exclude 7-AAD, whereas the membranes of dead and damaged cells are permeable to
7-AAD. Cells that stain positive for PE Annexin V and negative for 7-AAD are undergoing apoptosis. Cells that stain positive for both PE
Annexin V and 7-AAD are either in the end stage of apoptosis, are undergoing necrosis, or are already dead. Cells that stain negative for both PE
Annexin V and 7-AAD are alive and not undergoing measurable apoptosis.
559763 Rev. 8 Page 2 of 3
Reagents
1. PE Annexin V (component no. 51-65875X): Use 5 μl per test.
2. 7-Amino-Actinomycin (7-AAD) (component no. 51-68981E) is a convenient, ready-to-use nucleic acid dye. Use 5 μl per test.
3. 10X Annexin V Binding Buffer (component no. 51-66121E): 0.1 M Hepes/NaOH (pH 7.4), 1.4 M NaCl, 25 mM CaCl2. For a 1X working
solution, dilute 1 part of the 10X Annexin V Binding Buffer to 9 parts of distilled water.
Staining
1. Wash cells twice with cold PBS and then resuspend cells in 1X Binding Buffer at a concentration of 1 x 10^6 cells/ml.
2. Transfer 100 μl of the solution (1 x 10^5 cells) to a 5 ml culture tube.
3. Add 5 μl of PE Annexin V and 5 μl 7-AAD.
4. Gently vortex the cells and incubate for 15 min at RT (25°C) in the dark.
5. Add 400 μl of 1X Binding Buffer to each tube. Analyze by flow cytometry within 1 hr.
SUGGESTED CONTROLS FOR SETTING UP FLOW CYTOMETRY
The following controls are used to set up compensation and quadrants:
1. Unstained cells.
2. Cells stained with PE Annexin V (no 7-AAD).
3. Cells stained with 7-AAD (no PE Annexin V).
Other Staining Controls:
A cell line that can be easily induced to undergo apoptosis should be used to obtain positive control staining with PE Annexin V and/or PE
Annexin V and 7-AAD. It is important to note that the basal level of apoptosis and necrosis varies considerably within a population. Thus, even in
the absence of induced apoptosis, most cell populations will contain a minor percentage of cells that are positive for apoptosis (PE Annexin V
positive, 7-AAD negative or PE Annexin V positive, 7-AAD positive).
The untreated population is used to define the basal level of apoptotic and dead cells. The percentage of cells that have been induced to undergo
apoptosis is then determined by subtracting the percentage of apoptotic cells in the untreated population from percentage of apoptotic cells in the
treated population. Since cell death is the eventual outcome of cells undergoing apoptosis, cells in the late stages of apoptosis will have a damaged
membrane and stain positive for 7-AAD as well as for PE Annexin V. Thus the assay does not distinguish between cells that have already
undergone an apoptotic cell death and those that have died as a result of necrotic pathway, because in either case the dead cells will stain with
both PE Annexin V and 7-AAD.
Product Notices
This reagent has been pre-diluted for use at the recommended Volume per Test. We typically use 1 × 10^6 cells in a 100-μl experimental
sample (a test).
1.
2. Source of all serum proteins is from USDA inspected abattoirs located in the United States.
Caution: Sodium azide yields highly toxic hydrazoic acid under acidic conditions. Dilute azide compounds in running water before
discarding to avoid accumulation of potentially explosive deposits in plumbing.
3.
4. Please refer to www.bdbiosciences.com/pharmingen/protocols for technical protocols.
References
Andree HA, Reuingsperger CP, Hauptmann R, Hemker HC, Hermens WT, Willems GM. Binding of vascular anticoagulant alpha (VAC alpha) to planar
phospholipid bilayers. J Biol Chem. 1990; 265(9):4923-4928. (Biology)
Casciola-Rosen L, Rosen A, Petri M, Schlissel M. Surface blebs on apoptotic cells are sites of enhanced procoagulant activity: implications for coagulation events
and antigenic spread in systemic lupus erythematosus. Proc Natl Acad Sci U S A. 1996; 93(4):1624-1629. (Biology)
Homburg CH, de Haas M, von dem Borne AE, Verhoeven AJ, Reuingsperger CP, Roos D. Human neutrophils lose their surface Fc gamma RIII and acquire
Annexin V binding sites during apoptosis in vitro. Blood. 1995; 85(2):532-540. (Biology)
Koopman G, Reuingsperger CP, Kuijten GA, Keehnen RM, Pals ST, van Oers MH. Annexin V for flow cytometric detection of phosphatidylserine expression on
B cells undergoing apoptosis. Blood. 1994; 84(5):1415-1420. (Biology)
Martin SJ, Reuingsperger CP, McGahon AJ, et al. Early redistribution of plasma membrane phosphatidylserine is a general feature of apoptosis regardless of
the initiating stimulus: inhibition by overexpression of Bcl-2 and Abl. J Exp Med. 1995; 182(5):1545-1556. (Biology)
Raynal P, Pollard HB. Annexins: the problem of assessing the biological role for a gene family of multifunctional calcium- and phospholipid-binding proteins.
Biochim Biophys Acta. 1994; 1197(1):63-93. (Biology)
van Engeland M, Ramaekers FC, Schutte B, Reuingsperger CP. A novel assay to measure loss of plasma membrane asymmetry during apoptosis of adherent
cells in culture. Cytometry. 1996; 24(2):131-139. (Biology)
Vermes I, Haanen C, Steffens-Nakken H, Reuingsperger C. A novel assay for apoptosis. Flow cytometric detection of phosphatidylserine expression on early
apoptotic cells using fluorescein labelled Annexin V. J Immunol Methods. 1995; 184(1):39-51. (Biology)
559763