Ancell抗CD64(FcRI)F(ab’)2的作用
Ancell抗CD64(FcRI)F(ab’)2用于阻断调理血小板的吞噬作用
本研究着眼于抗血小板抗体糖基化对输血患者巨噬细胞介导的吞噬清除能力的影响。抗CD64单克隆抗体的F(ab’)2用作体外吞噬阻断对照。
“单核细胞来源的巨噬细胞用不同糖基化的抗HLA hIgG1调理的血小板的吞噬作用”Thijs L,Gesture Vidarsson等。
单核细胞来源巨噬细胞用不同糖基化的抗HLA hIgG1调理的血小板的吞噬作用
免疫介导的血小板难治性 (PR) 仍然是血小板输注情况下的一个重大问题,主要由针对 I 类人白细胞抗原 (HLA) 的同种异体抗体的存在引起。用这些同种抗体调理供体血小板可通过多种机制(包括抗体依赖性细胞吞噬作用 (ADCP))在输血后快速清除。有趣的是,并非所有同种异体免疫患者都会对不匹配的血小板输注产生PR,这表明患者之间HLA特异性IgG反应存在差异。以前,我们观察到抗HLA抗体的糖基化谱在PR患者之间差异很大,特别是在Fc半乳糖基化,唾液酸化和岩藻糖基化方面。在目前的研究中, 我们研究了不同Fc糖基化模式对单核细胞来源的人巨噬细胞吞噬调理血小板的影响,已知对补体沉积和FcγR结合的影响。我们发现,单核细胞来源的M1巨噬细胞对抗体和补体调理的血小板的吞噬作用不受这些定性IgG-聚糖差异的影响。
介绍
血小板输注是一种经常给药的治疗方法,可降低血小板减少症患者的死亡率和出血性并发症。血小板输注的一个主要问题是血小板难治性(PR),这是指多次血小板输注后血小板计数增加不足。PR 的发病率范围为 5%-15%,因患者特征和血小板制品制备而异 [1–4].在大约 20% 的 PR 病例中,血小板清除是免疫介导的,主要是由针对 I 类人白细胞抗原 (HLA) 的同种抗体的存在引起,偶尔还有人血小板抗原 (HPA) [5–9].用这些同种抗体调理供体血小板可在输血后不久通过抗体依赖性细胞毒性 (ADCC)、补体依赖性细胞毒性 (CDC) 和/或抗体依赖性细胞吞噬作用 (ADCP) 导致清除 [10–16].目前对于大量输血的同种异体免疫患者,目前的主要管理策略是广泛匹配血小板输注产品,以防止 PR 和随后的更差临床结局 [7–9].有趣的是,并非所有同种异体免疫患者都会因血小板输注不匹配而发生 PR [17,18],提示患者之间HLA特异性IgG反应的定性特征差异。
所有 IgG 分子都含有保守的 N-位于Fc区位置297的连接聚糖,影响抗体的结构和功能。该聚糖由 N-乙酰葡糖胺(GlcNAc)和甘露糖残基,可以通过岩藻糖,平分GlcNAc和最多两个半乳糖残基拉长,两者都可以被唾液酸残基覆盖。抗体Fc糖基化变化很大,之前在感染和同种异体免疫的情况下已经描述了改变的模式,已知这些改变会影响抗体效应功能,从而影响相关免疫应答的进展[19–27].例如,岩藻糖残基的缺失导致抗体与FcγRIIIa/b的结合亲和力增加,这可能导致相关效应功能增加,例如ADCC和ADCP [19–22,25,28,29].此外,半乳糖基化与补体活化特别相关[21,24,30,31].我们和其他人最近表明,半乳糖基化通过增强的六聚化增加了抗体激活经典补体途径的能力,这反过来又增加了补体沉积和CDC活性[23,30].唾液酸化略微增强补体活化,进一步增强[21,23,32],而平分GlcNAc对补体活化和FcγR结合均无影响[21].
之前,我们表征了在接受血小板输注的血液肿瘤患者中检测到的抗HLA I类抗体的糖基化谱[33]和被诊断为 PR 的患者 [20].抗HLA IgG特异性糖基化谱在患者之间差异很大。对于大多数患者,我们观察到与总IgG相比,HLA特异性IgG的Fc半乳糖基化和唾液酸化增加。此外,少数患者(35 名患者中有 2 名)也产生了岩藻糖基化水平极低的抗 HLA 抗体 [33].
在同种异体免疫和 PR 的背景下,输注的血小板主要被认为是在用抗 HLA 或 -HPA 同种抗体调理后被脾脏中的单核巨噬细胞清除 [8,10,11,13,34,35].存在几种途径,其中吞噬细胞可以通过非调理和调理受体检测其吞噬作用靶标。非调理受体对于识别病原体相关分子模式(PAMP)和凋亡细胞至关重要,而调理受体识别用调理素靶向清除的细胞,例如IgG和补体成分。识别IgG的最重要和有效的吞噬受体是FcγRI(CD64),FcγRII(CD32)和FcγRIII(CD16)和补体受体3(CR3或CD11b / CD18),用于识别iC3b和C3d [36,37].脾巨噬细胞具有高表达的CR3,FcγRI,FcγRII和FcγRIII[14,38–41].当血小板被IgG或补体成分调理时,血小板变得容易受到脾巨噬细胞表达的吞噬受体的结合,从而导致随后的吞噬和破坏。血小板通过脾正弦的缓慢通过进一步增强了这一过程[7,11,14].然而,补体系统受累以及血小板内在因素(如血小板凋亡和调理作用时活化)最近也被提出与 PR 中血小板存活率降低有关 [12,15,35,42–45].
有趣的是,对于抗体Fc糖基化对巨噬细胞使用不同糖基化的抗HLA同种抗体调理作用时血小板清除的影响知之甚少。特别是鉴于最近关于抗体Fc糖基化对FcγR结合和补体沉积的影响的发现,重要的是要更深入地了解抗体Fc糖基化对同种异体免疫时PR中涉及的清除机制的影响。在目前的研究中,我们研究了已知影响补体沉积和FcγR亲和力的不同Fc糖基化模式对单核细胞来源的人巨噬细胞调理化血小板吞噬的影响。使用单核细胞来源的M1巨噬细胞,因为它们具有高表达水平的FcγR和CR3, 人脾巨噬细胞也高度表达。我们发现,通过改变Fc糖基化谱增加补体沉积和/或FcγRIIIa/b亲和力并不影响人单核细胞来源的巨噬细胞对IgG调理化血小板的吞噬作用。 体外 型。
材料和方法
人类血液样本
在书面知情同意后,从匿名Sanquin献血者获得的血沉棕黄层中分离出单核细胞。血小板是从匿名健康志愿者的柠檬全血中分离出来的,并得到知情的书面同意。单核细胞和血小板不是从同一个个体获得的。所有程序均由Sanquin道德咨询委员会批准,并符合赫尔辛基宣言和荷兰法规。
重组糖工程抗HLA单克隆抗体的生产
本研究中使用的抗HLA单克隆抗体的生产和糖工程技术已被详细描述[46–52].简而言之,所有抗HLA mAb可变区域的蛋白质序列用于组装编码全人IgG1和PG LA LA Fc突变体(P329 G,L234A和L235A)的pcDNA3.1表达载体,这些突变体不能结合补体和FcγR[53].表达载体用于我们内部HEK Freestyle系统中重组抗体的生产。为了获得具有某些所需聚糖谱的抗体,在转染之前/期间使用化学抑制剂2-脱氧-2-氟-L-岩藻糖(2FF,碳合成物)来减少fc岩藻糖基化和5 mM D-半乳糖(Sigma Aldrich),并编码酶β-1,4半乳糖基转移酶1(B4GALT1)和β-半乳糖苷α-2,6-唾液酸转移酶1(ST6GALT1)的构建体,以增加半乳糖基化和唾液酸化。转染后6天纯化单克隆抗体,并进行液相色谱-质谱的IgG Fc糖基化分析[46,47,54].
表面等离子体共振 (SPR)
如前所述,通过IBIS M×96(IBIS技术)上的表面等离子体共振(SPR)评估抗体与人FcγR类别的结合[55,56].使用连续流动微量观察仪(Wasatch Microfluidics)将所有C端生物素化的hFcγR点到单个SensEye G-链霉亲和素传感器(Ssens)上,该传感器允许同时测量每种抗体与所有hFcγR的结合亲和力。生物素化的hFcγR以三倍稀释度点样,hFcγRIIa-H131,hFcγRIIIa-F158,hFcγRIIIb-NA1和hFcγRIIIb-NA2从30 nM到1 nM,hFcγRIIa-R131和hFcγRIIb的稀释范围为10 nM至0.3 nM,在补充有0.075%吐温-80(VWR,M126-100 ml),pH 7.4的PBS中,hFcγRIIIa-V158的范围为100 nM至3 nM。每个样品后用10nM Gly-HCl,pH 2.0进行再生。解离常数(KD)使用Rmax = 500的平衡拟合计算。 所有结合数据的分析和计算均使用洗涤器软件版本2(生物软件)和Excel完成。
单核细胞分离和分化为单核细胞来源的巨噬细胞
使用CD14+磁性微珠分离(Miltenyi Biotec)从血沉棕黄层衍生的PBMC中分离单核细胞,随后冷冻直至如前所述进一步使用[44,57].采用流式细胞术测定单核细胞纯度,为>90%。单核细胞分化为单核细胞来源的巨噬细胞,如所述[58].简而言之,单核细胞在第0天解冻并在24孔培养板(0.25×106 每孔单核细胞)在 IMDM 1640(龙沙)中存在 10 ng/mL 粒细胞-巨噬细胞集落刺激因子(GM-CSF、CellGenix),含有 10% 胎牛血清 (Bodinco) 100 U/mL 青霉素和 100 U/mL 链霉素(均为 Gibco),CO 为 5% CO2 37°C. 细胞共培养9天,培养第3天加入新鲜培养基和GM-CSF。
血小板分离、标记和调理
通过离心枸橼酸全血,从富血小板血浆(PRP)中分离出具有已知HLA分型的健康志愿者的血小板 g 20分钟,使用前面描述的方法进行优化以避免血小板活化[12,16].此后,10 体积% ACD(酸性柠檬酸盐葡萄糖,85 mM Na3-柠檬酸盐·2 H2O, 71 mM柠檬酸·H2O和111mM D-葡萄糖)加入。PRP离心(850 g 8分钟),并用洗涤缓冲液(WB;36mM柠檬酸·H2O,103 mM NaCl,5 mM KCl,5 mM EDTA,5.6 mM D-葡萄糖,pH 6.5)。将血小板浓度设置为6×108 PBS中的细胞/ mL,并在室温下与3.75μM PKH26(西格玛奥尔德里奇)在辊组上孵育20分钟。加入10体积%FCS终止标记过程,用WB洗涤标记的血小板并重悬于PBS + 0.5%BSA中。5 × 106 将血小板与等体积的重组抗HLA抗体一起孵育,并在室温下混合补体足够的人血清30分钟。对于某些条件,将血清在56°C下预孵育30分钟以灭活补体。用PBS + 0.5%BSA + 5 mM EDTA洗涤血小板3次,并重悬于巨噬细胞培养基中。补体沉积(C3b)通过用抗补体C3b/iC3b-APC抗体克隆染色一小部分血小板来评估补体沉积(C3b):3E7/C3b(1/250,生物传奇)
巨噬细胞对调理血小板的吞噬作用
对于吞噬作用测定,将调理的血小板在37°C下与同种异体巨噬细胞以1:40巨噬细胞:血小板比例孵育30分钟。对于某些条件,将巨噬细胞在室温下与10μg/ mL FcγR封闭抗体(抗CD16,抗CD32和/或抗CD64)和同种型对照预孵育30分钟。抗CD64(克隆10.1,阻断FcγRI)作为f(ab’)2片段从Ancell公司订购,而抗CD32(克隆AT10,阻断FcγRIIa/b/c),抗CD16(克隆3G8,阻断FcγRIIIa/b)和同种型(抗生物素)被克隆并生产为hIgG1 N297A P329 G,L234A和L235A,使它们无法结合C1q和FcγRs [53].此后,用PBS洗涤细胞并使用130mMli多卡因(Sigma Aldrich)和10mM EDTA(默克)收获。收获后,将巨噬细胞保持在冰上,并用冰冷的PBS + 0.5%牛血清白蛋白(BSA,Sigma Aldrich)+ 2 mM EDTA(默克)洗涤,随后用冰冷的PBS洗涤。收获后,将细胞用3.7%多聚甲醛(Sigma Aldrich)在PBS中固定在室温下15分钟。接下来,用PBS + 0.5%BSA洗涤细胞,并使用APC标记的抗HLA-DR(克隆L243,BD Biosciences)和BV421标记的抗CD42a(克隆ALMA.16,BD Biosciences)染色20分钟在PBS + 0.5%BSA的室温下。用PBS + 0.5%BSA洗涤细胞,并使用BD LSR II流式细胞仪和成像流式细胞术(ImageStreamX Mark II成像流式细胞术,默克密理博)进行分析。使用Flowjo v 10.8.1分析流式细胞术数据; 基于FSC / SSC,单细胞和HLA-DR+对细胞进行门控,之后对PKH26标记的血小板和抗CD42a-BV421(PKH26+ CD42a-:吞噬;PKH+ CD42a+:结合的血小板;补充图S3A)。使用IDEAS v6软件分析成像流式细胞术数据,涉及对门细胞的纵横比强度/面积Ch01进行门控,随后对焦点细胞(梯度RMS Ch01)和HLA-DR+细胞进行门控巨噬细胞,之后对PKH26标记的血小板和抗CD42a-BV421阳性细胞进行门控(补充图S3B)。 使用IDEAS v6软件分析成像流式细胞术数据,涉及对门细胞的纵横比强度/面积Ch01进行门控,随后对焦点细胞(梯度RMS Ch01)和HLA-DR+细胞进行门控巨噬细胞,之后对PKH26标记的血小板和抗CD42a-BV421阳性细胞进行门控(补充图S3B)。 使用IDEAS v6软件分析成像流式细胞术数据,涉及对门细胞的纵横比强度/面积Ch01进行门控,随后对焦点细胞(梯度RMS Ch01)和HLA-DR+细胞进行门控巨噬细胞,之后对PKH26标记的血小板和抗CD42a-BV421阳性细胞进行门控(补充图S3B)。
统计学
统计分析在Windows版GraphPad Prism 8.02(263)中执行。使用普通单因素方差分析和邓尼特多重比较检验分析条形图。重要性水平设定为 p ≤ .05.*、**、*** 和 **** 表示统计显著性 p 分别为<.05、≤.01、≤.001和≤.0001。
结果
为了确定抗HLA同种抗体的Fc糖基化对补体和/或FcγR介导的血小板吞噬作用的影响,建立了监测人单核细胞来源巨噬细胞吞噬血小板吞噬作用的系统。糖基化谱改变的抗HLA单克隆抗体(mAb)(补充图S1A-C)如下所述[46,47]并进行基于液相色谱-质谱的IgG Fc糖基化分析,以确认预期的糖基化曲线(补充图S1D)。
将血小板与未修饰和糖工程化的抗HLA hIgG1 mAb(SN230G6、SN607D8和W6/32)在补体充足血清存在下孵育,从而实现抗体和补体调理。只有SN230G6和SN607D8抗体的组合导致强烈的C3b沉积,尽管泛HLA I类识别W6/32(补充图S1B)自行引起补体沉积(补充图S1E),与我们之前的观察结果一致[47].半乳糖基化和唾液酸化升高的抗体显著增强了补体沉积。mAb的岩藻糖基化对补体沉积没有影响(补充图S1E)。PG LALA Fc突变体,不能结合C1q和FcγR[53],也没有热灭活血清(HI血清)导致C3b沉积(补充图S1F)。通过SPR阵列评估了这些糖工程抗体与人FcγR的结合,证实了FcγRIIIa/b的亲和力增加,而FcγRIIa/b的亲和力差异没有观察到(补充图S2)。
调理的PKH26标记的血小板与单核细胞来源的M1样巨噬细胞(图 1A).这些分化的巨噬细胞表达所有类别的FcγR(FcγRI(CD64),FcγRII(CD32),FcγRIII(CD16))以及CR3(CD11b / CD18)(图1B),所有参与吞噬作用的关键受体[8,11,36,37,59].使用成像和常规流式细胞术测定血小板的内化(门控策略分别在补充图S3A和3B中描述)。血小板特异性标志物CD42a用于检测巨噬细胞外部的血小板(图1C).大多数血小板阳性(PKH+)巨噬细胞是CD42a-。此外,使用成像流式细胞术显示,大多数PKH+ CD42a +事件由同时具有吞噬作用(PKH + CD42a-)和结合(PKH+ CD42a +)血小板的巨噬细胞组成,表明总PKH+区室与血小板吞噬的定量相关(图 1D-E 和补充图S3A,下面板)。因此,通过常规流式细胞术分析PKH+巨噬细胞的总区室以评估血小板吞噬作用,因为排除PKH + CD42a +事件会导致吞噬效率的低估。
数字 1 的 2
图1. A) 监测调理化血小板吞噬作用的实验装置的示意图概述:用GM-CSF将CD14 +单核细胞培养9天,以分化为单核细胞来源的巨噬细胞(MQ M1)。此后,巨噬细胞在有和没有FcγR阻断剂的情况下预先孵育。来自HLA-A2+供体的新鲜分离的血小板用PKH26标记,并在补体充足或热灭活(HI)血清存在下与未修饰和糖工程化的抗HLA单克隆抗体预孵育,用于抗体和补体调理。将巨噬细胞和血小板洗涤并在37°C下共孵育30分钟,并通过流式细胞术和Imagestream进行分析 B) 通过流式细胞术分析的单核细胞来源巨噬细胞表面补体受体3(Cd11b / cd18)和FcγR(FcγRI,FcγRII,FcγRIII)的表达水平。 C-E) 血小板的内化是用 C) 常规和 D-E) 成像流式细胞术。抗CD42a-BV421染色与PKH26联合用于鉴定附着在细胞外部的血小板。显示了通过成像流式细胞术获得的指示象限的代表性图像。

与未调理的血小板(图 2A,B).以抗体浓度依赖性方式观察吞噬作用,吞噬细胞MQ的最大百分比为1μg/mL。尽管半乳糖基化和唾液酸化水平升高的糖工程mAb显著增强了血小板上的补体沉积(补充图S1E),但这些并没有导致更高水平的后续吞噬作用(图2C).此外,用非糖基化IgG调理,这增加了对FcγRIII的亲和力([21]和补充图S2),与未修饰的抗体(图2C).此外,将血小板与单独的未修饰抗HLA单克隆抗体SN230G6或SN607D8孵育可增强吞噬作用(补充图S4A-B),并且不受抗体Fc聚糖修饰的影响(补充图S4C-D)。与SN230G6 + SN607D8组合类似,与未调理的血小板相比,将血小板与泛HLA I类抗体W6/32孵育导致吞噬作用显着增加(图 2D,E).以抗体浓度依赖性方式观察吞噬作用,不受任何抗体聚糖修饰(图 2E,F).这些结果表明,观察到的吞噬作用主要不是通过补体受体或FcγRIIIa/b介导的。
图2. 单核细胞来源的巨噬细胞吞噬补体和抗体调理血小板 A) 绝对和 B) 在补体充足血清存在下,与不同浓度的未修饰的hIgg1抗HLA单克隆抗体(mAb)SN230G6 + SN607D8一起孵育的血小板吞噬相对水平 C) 在补体充足血清存在下,用未修饰和糖工程的hIgg1 SN230G6 + SN607D8 mAb预孵育的血小板之间的吞噬作用差异。 D) 绝对和 E) 在补体充足血清存在下,与不同浓度的未修饰的泛抗 HLA I 类 hIgg1 mAb W6/32 预孵育的血小板吞噬相对水平 F) 在补体充足血清存在下,用未修饰和糖工程hIgg1 W6 / 32 mAb预孵育的血小板之间的吞噬作用差异。 G-H) 在补体充足或热灭活 (HI) 血清存在下,用 1 μg/ml 未修饰或 PG LA LA Fc 突变抗 HLA mAb(SN230G6+SN607D8 或 W6/32)预孵育的血小板的相对吞噬水平 A-H) 吞噬作用水平(%)定义为PKH26+巨噬细胞部分(Q1 + Q2)的百分比。数据表示在2-4个独立实验中使用的2-5个不同单核细胞供体的2个技术重复的平均值和SD,对于每个独立实验,还使用了不同的血小板供体。数据点的颜色表示不同的单核细胞供体。对于标准化,如图所示,用1μg/ ml未修饰的抗HLAmAb孵育的血小板的吞噬作用水平设置为1。采用Dunnet多重比较检验的普通单因素方差分析进行统计分析。*p ≤ .05, ****p ≤ .0001 和 ns = 不显著 .
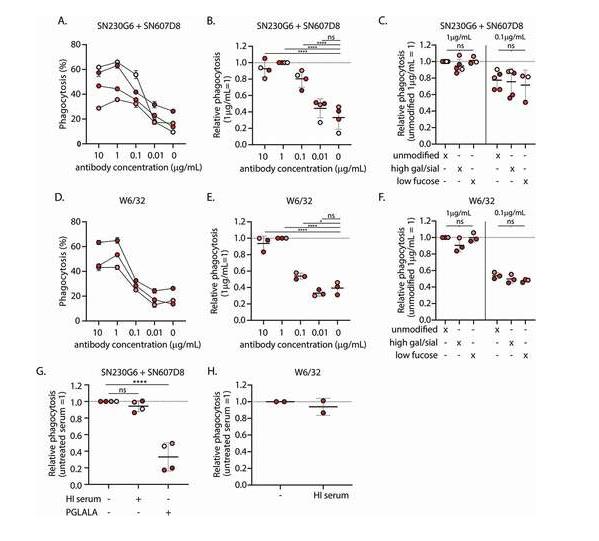
与此一致,用HI血清调理的血小板不会导致巨噬细胞吞噬作用减弱(图2G).然而,用PG LA LA Fc突变体进行血小板调理作用显着消除了吞噬作用(图2G),提示吞噬作用依赖于 FcγR,但与补体无关。在W6/32中观察到相同的趋势,其吞噬作用似乎不受HI血清(图2H).然而,必须注意的是,在补体充足血清存在的情况下,将血小板与未修饰的W6/32抗体孵育仅会导致低C3b沉积(补充图S1E)。
为了初步评估哪种FcγR可能参与抗HLA调理血小板的吞噬作用,使用了FcγR阻断抗体。虽然阻断FcγRII或FcγRIII导致吞噬作用的减少可以忽略不计,但单独阻断FcγRI或与FcγRII和FcγRIII联合阻断,导致单核细胞衍生巨噬细胞对调理血小板的吞噬作用降低(补充图S4E-F)。我们假设在阻断FcγRI时,对于用低岩藻糖化抗体调理的血小板,对FcγRIII的亲和力增加可能会变得明显。引人注目的是,FcγRI阻断抗体的存在似乎不会影响低岩藻糖基化W6/32抗体的吞噬作用(补充图S4G)。
Ancell抗人Fc受体抗体,Fab,F(ab’)2,偶联物
抗CD16 (FcgRIII)
抗CD32 (FcgRII)
抗CD64 (FcgRI)
Ancell 著名的专注做人种属的流试抗体提供商。
上海金畔生物科技有限公司
-
国内试剂耗材经销代理。
-
国外试剂的订购。可提供欧美实验室品牌的采购方案。
-
提供加急物流处理,进口货物,最快交期1-2周。
-
进出口货物代理服务。
-
公司代理众多有名生命科学领域的研究试剂、仪器和实验室消耗品品牌:CELL DATA,Alamanda Polymers, cstti,Click Chemistry tools,Nanoprobes,Ancell,NANOCS,Ambeed, Inc,SPEED BioSystems, LLC,Tulip Biolabs, Inc,Torrey Pines Biolabs,magsphere ,FabGennix International ,paratechs,Medicago,Oraflow,CWE,Wasatch Photonics, alphananote, It4ip, proteoform, Caprico等,重点合作品牌 Lee Biosolutions,chematech,Nanopartz,denovix,Atto tec,macrocyclics等。
-
质量保证,所有产品都提供售后服务。付款方式灵活。公司坚持“一站式”服务模式,为客户全面解决实验、生产、开发需求。公司整合国际与国内资源,加强网络建设,提高公司内部运作效率,为客户提供方便、快捷的服务。
-
公司突出创新思维,提高工作效能,减低运作成本,为客户提供优惠的价格。
